556 НАУЧНАЯ СЕССИЯ ОБЩЕГО СОБРАНИЯ РАН
ФЕМТОБИОЛОГИЯ: ПЕРВИЧНЫЕ ПРОЦЕССЫ ФОТОСИНТЕЗА
ДОКЛАД АКАДЕМИКА В.А. ШУВАЛОВА И ДОКТОРА ФИЗИКО-МАТЕМАТИЧЕСКИХ НАУК О.М. САРКИСОВА
Фемтосекундные исследования в биологии стали возможными в результате существенного прогресса лазерной техники за последние 50 лет. На мировом рынке научного оборудования предложены фемтосекундные генераторы, усилители, параметрические генераторы, создающие излучение в широкой области спектра, высокочувствительная измерительная техника, позволяющая проводить измерения спектров излучения в диапазоне от ультрафиолета до инфракрасной области при использовании компьютеров для управления временными фемтосекундными (ФС) задержками и всем процессом измерения.
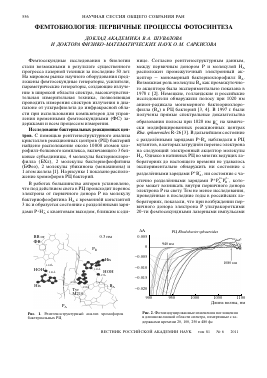
Исследование бактериальных реакционных центров. С помощью рентгеноструктурного анализа кристаллов реакционных центров (РЦ) бактерий найдено расположение около 10000 атомов хлорофилл-белкового комплекса, включающего 3 белковые субъединицы, 4 молекулы бактериохлоро-филла (БХл), 2 молекулы бактериофеофитина (БФео), 2 молекулы убихинона (менахинона) и 1 атом железа [1]. На рисунке 1 показано расположение хромофоров РЦ бактерий.
В работах большинства авторов установлено, что под действием света в РЦ происходит перенос электрона от первичного донора Р на молекулу бактериофеофитина НА с временной константой 3 пс и образуется состояние с разделёнными зарядами Р+Н А с квантовым выходом, близким к еди-
нице. Согласно рентгеноструктурным данным, между первичным донором Р и молекулой НА расположен промежуточный электронный акцептор — мономерный бактериохлорофилл ВА. Возможная роль молекулы ВА как промежуточного акцептора была экспериментально показана в 1978 г. [2]. Немецкие, голландские и российские исследователи обнаружили полосу при 1020 нм анион-радикала мономерного бактеориохлоро-филла (ВА) в РЦ бактерий [3, 4]. В 1997 г. были получены прямые спектральные доказательства
образования полосы при 1020 нм ВА на химически модифицированных реакционных центрах Rba. sphaeroides Я-26 [3]. В дальнейшем состояние
с разделёнными зарядами Р+ВА наблюдали в РЦ мутантов, в которых затруднён перенос электрона на следующий электронный акцептор молекулы НА. Однако в нативных РЦ во многих ведущих лабораториях до настоящего времени не удавалось экспериментально обнаружить ни состояние с
разделёнными зарядами Р+ВА, ни состояние с частично разделёнными зарядами Р*РА+РВ-, которое может возникать внутри первичного донора электрона Р на свету. Тем не менее исследования, проведённые в последние годы в российских лабораториях, показали, что при возбуждении первичного донора электрона Р ультракороткими 20-ти фемтосекундными лазерными импульсами
Рис. 1. Рентгеноструктурный анализ хромофоров бактериальных РЦ
РЦ Rhodobacter sphaeroides
Рис. 2. Фотоиндуцированные изменения поглощения в длинноволновой области спектра, измеренные с задержками времени 20, 100, 250 и 480 фс
850 900 950 1000 1050 1100
Длина волны, нм
Рис. 3. Дифференциальные свет-минус-темнота спектры поглощения реакционных центров КЬа. sphaeroides, измеренные на интервале времени от 480 фс до 1650 фс. Вставка: фотоиндуцированные изменения поглощения в длинноволновой области спектра, измеренные на том же интервале времени
формируется колебательный ядерный волновой пакет, когерентное движение которого по поверхности потенциальной энергии возбуждённого состояния Р* сопряжено с быстрыми начальными реакциями переноса электрона [5, 6]. Движение ядерных волновых пакетов по потенциальной поверхности возбуждённого состояния первичного донора электрона Р* сопровождалось обратимым и необратимым переносом электрона между Р* и первичным акцептором электрона ВА. Высокая эффективность и направленность первичного разделения зарядов в РЦ обусловлена сочетанием когерентного переноса электрона от возбуждённого первичного донора электрона Р* к первичному акцептору ВА и некогерентного изменения ядерных координат за счёт переориентации гид-роксильной группы тирозина М210 [5]. При этом кинетика переноса электрона с первичного донора Р* на первичный акцептор ВА в реакционных центрах пурпурных бактерий характеризуется двумя временными константами 1.1 пс (80%) и 4.3 пс (20%) [6, 7].
В настоящей работе исследована динамика процессов преобразования возбуждённого состояния первичного донора электрона Р* в состояние с разделёнными зарядами Р*РА+РВ- и переноса электрона из этого состояния на ближайший электронный акцептор ВА в реакционных центрах пурпурной бактерии ЯЬа. sphaeroides при возбуждении первичного донора электрона фемто-секундными импульсами света малой мощности
и относительно большой длительности (40 фс) для устранения дополнительного вклада колебательных движений при участии ядерных волновых пакетов.
Методом фемтосекундной спектроскопии обнаружено, что в фотосинтетических реакционных центрах пурпурной бактерии RhodoЬacter sphaeroides стимулированное излучение с максимумом при 935—940 нм и увеличение поглощения при 1080 нм отражают один и тот же процесс, а именно разделение зарядов между молекулами бактериохлорофиллов (БХл) специальной пары Р (РА и Рв) (рис. 2). Это приводит к формированию состояния с частично разделёнными зарядами
Р*РА+РВ- с временной константой около 180 фс. В случае образования волновых пакетов при использовании импульсов света длительностью ~20 фс наблюдается моментальный перенос электрона из этого состояния на последующий акцептор Ва.
В случае длительных импульсов возбуждения (>40 фс) образование состояния с частично разделёнными зарядами Р*РА+РВ- предшествует по времени (~1 пс) перемещению электрона от первичного донора электрона Р* на первичный электронный акцептор ВА и появлению полосы поглощения анион-радикала бактериохлорофилла
ВА при 1020 нм (рис. 3). Дальнейшая задержка по времени приводит к образованию полосы анион-
радикала бактериофеофитина Н А при 960 нм. Кинетика возникновения различных полос поглоще-
558
НАУЧНАЯ СЕССИЯ ОБЩЕГО СОБРАНИЯ РАН
ДА
-0.02 -0.04 -0.06 -0.08 -0.10 -0.121-
-500
500 1000 1500 2000 2500
Время, фс
Рис. 4. Кинетики фотоиндуцированных изменений поглощения реакционных центров Rba. sphaeroides в области 870 нм (о), 940 нм (★), 1080 нм (•) и 1020 нм (А), измеренные в интервале времени от —500 до 2700 фс
ния в ближней инфракрасной области приведена на рисунке 4, из которого видна последовательность переноса электрона в РЦ фотосинтезиру-ющих бактерий.
Фотосистема 1 зелёных растений и цианобакте-
рий. Зелёные растения, водоросли и цианобакте-
Р700
Рис. 5. Структура реакционного центра фотосистемы 1 цианобактерии Synechococcus elongatus. А и В указывают расположение молекул хлорофилла в цепях А и В хлорофилл-белкового комплекса. FA, Fв и Fх — расположение соответствующих железо-серных центров
рии содержат в себе фотосистему 1 (ФС 1), которая представляет собой хлорофилл-белковый комплекс, использующий энергию света для восстановления ферредоксина [8, 9]. Согласно данным рентгеноструктурного анализа с разрешением 2.5 А комплекс ФС 1 цианобактерий Synechoc-occus elongatus состоит из 12 белковых субъединиц (центральные — Р8аА, Р8аВ) и 127 кофакторов (96 молекулами хлорофилла (Хл a), 22 молекулами Р-каратиноидов, 2 молекулами филлохинона и 4Fe-4S центрами Бх, БА и Бв) [10]. Большая часть Хл a служит в качестве антенных пигментов. Их основная функция — поглощение светового возбуждения и его перенос в реакционный центр, расположенный в середине комплекса ФС 1.
ФС 1 содержит в себе реакционный центр, который состоит из шести молекул хлорофилла: первичного донора электронов Р700 (гетеродиме-ра Хл a и Хл a', обозначаемых как еС—А1 и еС—В1 соответственно), двух дополнительных хлоро-филлов (еС—В2 и еС—А2) и двух хлорофиллов еС—А3 и еС—В3. В настоящее время неясно, что является начальным электронным акцептором Ао. Одни авторы считают, что это еС—А3 и еС—В3, другие полагают, что это димеры еС—А2—еС—А3 и еС—В2—еС—В3. Таким образом, шесть молекул хлорофилла, две молекулы филлохинона образуют две ветви переноса электрона, обозначаемые как А и В (рис. 5).
Принято, что первичное разделение зарядов в РЦ ФС 1 приводит к восстановлению А0, образуя
радикал-ионную пару Р700+А -. (Впервые спектр
А - описан в работе В.А. Шувалова с соавторами в 1986 г. [11].) Затем неспаренный электрон мигрирует на вторичный филлохиноновый акцептор А1 ^К—А или QK—B), на [4Fe—4S] центр Fх и в конечном счёте на [4Fe—4S] центры FA и Fв с последующим переносом на ферредоксин.
На рисунке 6 показаны спектры фотоиндуци-рованного поглощения восстановленной ФС 1 при разных временных задержках. Видно, что к 90 фс происходит образование дифференциального спектра W-образного вида, включающего
как максимум выцветание при 690 нм (А -), так и выцветание при 705 нм (Р700+). К 70 пс этот спектр преобразуется в известный спектр окисления Р700. В окисленных РЦ никакого W-образ-ного спектра не наблюдается при коротких (до 100 фс) задержках, а при 70 пс сигнал стремится к 0, показывая отсутствие образования Р700+ при фс возбуждении.
На рисунке 7 продемонстрированы дифференциальные спектры при наиболее коротких задержках от 0 до 100 фс. Видно, что при задержках
0
0.5
т 0
О -0.5
X
-1.0
-1.5
-2.0
\ А \ \\ - - ¿¡^Пгтгг^---V ...
м/Г Г " '......
0 4~Т \ /у
V я т \ м 1 \/ у
— л 3-¥м
2—\'г
| I 1 1 1V 1 1 * 1
400 450 500 550
600 650 700 Длина волны, нм
В
0 -2 -4 -6
400 450 500 550
600 650 700 Длина волны, нм
0 -1 -2 -3 -4
\ С ^г^Ч^ ^ч
6—
5—1^^Ж
4-Ж^Уё
- 3 1 1
- 2-У1
1 1 1 , , , 1\А
400 450 500 550
600 650 700 Длина волны, нм
Рис. 6. Дифференциальные спектры поглощения восстановленной ФС 1 на временах задержки от —130 фс до 100 пс. (параметры возбуждающего импульса — 20 фс, 720 нм, 20—50 нДж). А — открытые РЦ, возбуждение 20 нДж, временная задержка: 0--130 фс; 1 —
90 фс; 2 — 8.5 пс; 3 — 16 пс; 4 — 71 пс. В — открытые РЦ, возбуждение 50 нДж, временная задержка: 1 — 120 фс; 2 — 5.5 пс; 3 — 10.5 пс; 4 — 25.5 пс; 5 — 95.5 пс. Вставка: на рисунке 6, В показано перекрывание полосы поглощения в Qy переходе ФС 1 (левая ось) и спектр ла
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.