КООРДИНАЦИОННАЯ ХИМИЯ, 2007, том 33, № 10, с. 785-786
УДК 548.736.6
КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА РЯДА КРИСТАЛЛОГИДРАТОВ
ДВОЙНЫХ МОЛИБДАТОВ
© 2007 г. Д. Д. Макитова*, В. В. Ткачев**, |Л. О. Атовмян|:
*Кабардино-Балкарская государственная сельскохозяйственная академия, г. Нальчик **Институт проблем химической физики РАН, г. Черноголовка Поступила в редакцию 30.08.06 г.
Проведен сравнительный анализ структур ряда двойных молибдатов с катионом лития, LiM(MoO4) ■
■ Н20 (М = К+, Rb+, N Н+). Катионы лития, исключая соединение LiNa(MoO4) ■ Н20, имеют тет-
раэдрическую координацию, образованную атомами кислорода молекул воды и молибдатогрупп. Для структуры LiNa(MoO4) ■ Н20 установлен редкий координационный полиэдр лития - тригональ-ная бипирамида, образуемая атомами О молекул воды и оксоанионами.
В течение ряда лет проводилось комплексное исследование новых соединений молибдена и вольфрама, синтезированных в следующих тройных водно-солевых системах путем изотермического испарения: Li2MoO4-Na2MoO4 (K2MoO4, Rb2MoO4, (NH4)2MoO4)-H2O и Li2MoO4-OCN2H4-H2O. Поскольку методы химического анализа фиксируют лишь брутто-состав продуктов реакции, их структура и состав были установлены методом рентге-ноструктурного анализа (РСА) (таблица) [1-6].
Исследованные соединения общей формулы LiM(MoO4) ■ nH2O (M = Li (I), K (II), Rb (III), Na (IV), NH4 (V); n = 1 (II, III, V), 2 (IV), 6 (I)) и Li2MoO4 ■ 3OCN2H4 (VI) имеют структуры, содержащие незначительно искаженный тетраэдриче-ский анионный фрагмент [MoO4]2-; расстояния Mo-O (1.751(1)-1.758(2) Á) отвечают обычной координационной связи в молибдатогруппах.
По данным РСА, основные структурообразующие элементы в исследованных соединениях
I-VI островного типа - оксоанионы Mo O4 , катионы лития и других щелочных металлов, а также
три симметрически независимых молекулы карбамида в структуре VI.
Во всех исследованных структурах, исключая структуру IV, ион имеет тетраэдрическую координацию, образованную молекулами воды и атомами кислорода различных молибдатогрупп. Расстояния П-О (1.92-1.99 А) свидетельствуют о значительном зарядно-контролируемом взаимодействии между донором с высокой орбитальной электроотрицательностью (атомом кислорода) и акцептором с низкой орбитальной электроотрицательностью (ионом Ы+). Как показано методом расчета локального баланса валентностей, при таких расстояниях вклад валентных усилий от катиона Ы+ в баланс на атомах кислорода достаточно высок и превышает среднюю величину вклада от больших по размеру катионов щелочных металлов.
В отличие от большинства известных структур, в которых атомы лития имеют преимущественно тетраэдрическую (реже октаэдрическую) конфигурацию, структура IV представляет редкий пример координационного полиэдра лития - триго-нальной бипирамиды, сформированной атомами
Основные кристаллографические параметры соединений I-VI [1-6]
Соединение Параметр элементарной ячейки, Á Угол, град Пр. гр., Z Я-фактор
a b c а в Y
LiNa(MoO4) ■ 6H2O (I) 15.132(5) 14.482(5) 8.732(5) 90 90 45.83(3) Bb, 4 0.068
LiK(MoO4) ■ H2O (II) 7.740(5) 10.612(5) 12.847(5) 90 90 90 Pcab, 8 0.030
LiNa(MoO4) ■ 2H2O (IV) 8.219(1) 10.372(2) 13.277(3) 90 90 90 Pbca, 8 0.024
LiNH4(MoO4) ■ H2O (V) 7.865(2) 10.883(2) 12.956(2) 90 90 90 Pcab, 8 0.058
Li2MoO4 ■ 3(OCN2H4) (VI) 7.865(2) 9.819(5) 8.644(5) 90 118.68 90 Pa, 2 0.032
* Для соединения LiRb(MoO4) ■ 6H2O (III) Я-фактор 0.032.
786
МАКИТОВА и др.
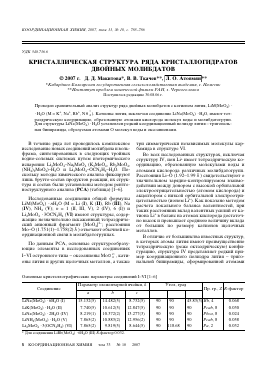
® OO) Na »Li
Проекция структуры LiNaMoO4 • 2H2O на плоскость xz.
О двух молекул воды и трех анионных фрагментов (рисунок).
Увеличение КЧ лития приводит к ослаблению контактов Li•••O до 2.18 А по сравнению с аналогичными параметрами в тетраэдрических полиэдрах лития. При переходе от соединений лития к соединениям калия КЧ последнего возрастает до восьми в силу известной закономерности, согласно которой в мономолибдатах одновалентных катионов в ряду от лития до цезия структура меняется так, что КЧ катиона возрастает от 4 до 10.
В ходе исследования установлена изоструктур-ность кристаллогидратов II, III и V. Атомы азота, позиции которых в структуре V соответствуют положению атомов калия в структуре II и рубидия - в III, участвуют в Н-связях N-№"0 (N-0 2.79-2.97 А) с донорными атомами кислорода оксоанионов
Мо 04 . При этом атомы азота образуют водородные связи именно с теми атомами кислорода, для которых расстояния О-К или О-^Ь в полиэдрах калия или рубидия наименьшие.
Во всех исследованных кристаллогидратах ам-бидентный характер молекулы воды, проявляющийся в ее способности выступать как в качестве донора электрона, так и донора протона, приводит к тому, что в межмолекулярные связи молекул воды вовлекаются и атом кислорода (координа-
ция к катионам Li+, К+, Rb+, N Н+), и атомы водорода (образуются водородные связи с оксоанионами). В результате атомы кислорода молекул воды имеют тетраэдрическую координацию,
формируемую анионами Мо 04 и соответствующими катионами.
Для изоструктурных кристаллогидратов LiNH4(Mo04) • Н20 (V), LiK(Mo04) • Н2О (II) и LiRb(Mo04) • Н2О (III) замещение катионов калия и рубидия на группу N^4 приводит к ослаблению водородных связей, образуемых молекулами воды с оксоанионами (О-О 2.64, 2.75 и 2.79 А для II, III и V соответственно).
Следует отметить также укорочение расстояния Li•••0 до 1.93 А (по сравнению с 1.96 А) при замещении атомов щелочных металлов катионом
N Н+. По-видимому, такое усиление взаимодействия молекул воды с ионом Li+ связано с его более сильными по сравнению с группой N^4 поляризующими и электроноакцепторными свойствами. Вклад валентных усилий от катиона лития в баланс на атомах кислорода существенно превышает среднюю величину вклада от больших по размеру катионов К+ или Rb+, что свидетельствует о значительном зарядно-контролируемом взаимодействии.
Обращает на себя внимание отсутствие водородных связей между молекулами воды во всех исследованных кристаллогидратах, общим мотивом которых является наличие бесконечных цепочек Мо02 "-Н20--Мо04 , связывающих между собой оксомолибденовые анионы.
СПИСОК ЛИТЕРАТУРЫ
1. Макитова Д.Д., Ткачев ВВ., Мирзоев P.C., Ка-ров З.Г. // Коорд. химия. 1989. Т. 15. № 10. С. 1334.
2. Макитова Д.Д, Ткачев В В., Каров З.Г, Мирзоев P.C. // Коорд. химия. 1989. Т. 15. № 12. С. 1663.
3. Макитова Д.Д, Ткачев ВВ., Атовмян Л.О. // Коорд. химия. 1990. Т. 16. № 5. С. 616.
4. Макитова Д.Д, Ткачев В.В, Атовмян Л.О. // Коорд. химия. 1990. Т. 16. № 5. С. 616.
5. Макитова Д.Д, Ткачев В В., Атовмян Л.О. // Коорд. химия. 1990. Т. 16. № 6. С. 793.
6. Макитова Д.Д., Ткачев В В., Атовмян Л.О, Каров З.Г. // Коорд. химия. 1991. Т. 17. № 10. С. 1330.
г
х
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.