КООРДИНАЦИОННАЯ ХИМИЯ, 2007, том 33, № 4, с. 296-299
УДК 541.49+546.97
МЕТАЛЛОФАНОВЫЕ СТРУКТУРЫ НА ОСНОВЕ ^ис(ФОСФОРИЛИРОВАННЫХ) ДИГИДРОКСИНАФТАЛИНОВ
И -АНТРАЦЕНОВ
© 2007 г. П. В. Слитиков, А. В. Петров, Е. Н. Расадкина, Э. Е. Нифантьев
Московский педагогический государственный университет Поступила в редакцию 06.07.06 г.
Синтезированы оригинальные металлофаны, содержащие в мостиках атомы платины(П). В качестве исходных ароматических компонентов использованы бис(фосфорилированные) дигидроксинафтали-ны и -антрацены. Полученные комплексы исследованы методами ЯМР и масс-спектроскопии.
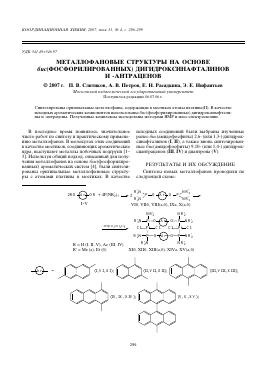
В последнее время появилось значительное число работ по синтезу и практическому применению металлофанов. В молекулах этих соединений в качестве мостиков, соединяющих ароматические ядра, выступают металлы побочных подгрупп [13]. Используя общий подход, описанный для получения металлофанов на основе бис(фосфорилиро-ванных) ароматических систем [4], были синтезированы оригинальные металлофановые структуры с атомами платины в мостиках. В качестве
исходных соединений были выбраны изученные ранее бмс(амидофосфиты) 2,6- (или 1,3-) дигидрок-синафталинов (I, II), а также вновь синтезированные бмс(амидофосфиты) 9,10- (или 1,4-) дигидрок-сиантраценов (III, IV) и диантрона (V).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтезы новых металлофанов проводили по следующей схеме:
2RO-(A^-OR + 4P(NR2)3
I-V
2Pt(CH3CH)2Cl2
R = H (I, II, V); Ac (III, IV) R' = Me (a), Et (6)
2 2 >-0-fAr+0-P^ 2 -R2N Ч_У NR2
VI6, VII6, VIII(a,6), IXa, X(a,6) NR2 NR2
I 2 | 2
R2 N—p— 0-^NR2
Cl—pt—Cl Cl—Pt—Cl R2 n-]^-
R2N NR2
XI6, XII6, XIII(a,6), XIVa, XV(a,6)
(III, VIII, XIII);
Бис(фосфорилированные) нафтодиолы (У1б, УНб) и антрадиолы (УШа, УШб, 1Ха, Ха, Хб), полученные взаимодействием диолов I-V с полными амидами фосфористой кислоты в соотношении 1 : 2 в ацетонитриле и пиридине соответственно, после удаления соответствующего растворителя и выдерживания остатка в вакууме растворяли в мети-лендихлориде и вводили в реакцию комплексооб-разования. Важным экспериментальным условием в случае нафтодиолов и диантрона является тщательное удаление вторичного амина после окончания реакции бис(фосфорилирования). Это связано с тем, что он мешает комплексообразованию фосфитов с солями платины вследствие более высокого сродства к ним. Во всех случаях комплексообра-зование протекало гетерогенно.
В спектре ЯМР 31Р комплексов (XI, ХШ-ХУ) присутствовует основной сигнал в области 97-100 м. д. и по два сателлитных сигнала в области 46-50 и 150-156 м. д., что связано с магнитной неэквивалентностью атомов платины. Сигнала, характерного для Р(Ш), не вступившего в комплексо-образование, не наблюдалось; следовательно, ком-плексообразование проходит по двум фосфорным центрам. В пользу образования металлофановой структуры говорит еще и тот факт, что бис(фосфо-рилированные) дигидроксинафталины и антрацены, как показал РСА [3, 5], являются жесткими системами и не могут образовывать комплексы хе-латного типа. В спектрах ЯМР 1Н соединений (XI-XV) присутствуют сигналы всех групп протонов, соотношение интегральных интенсивностей которых полностью соответствует ожидаемым структурам. Следует отметить, что как в случае с нафталиновыми, так и с антраценовыми производными сигналы всех групп протонов уширены. Вероятно, это связано с наличием большого количества заторможенных конформеров у образующихся ме-таллофанов.
В масс-спектрах MALDI-TOF комплексов Х1б и ХГУа присутствуют пики со значениями m/z 1561 и 1425 соответственно, совпадающими с расчетны-
ми для димерной формы соединений. Такой результат также свидетельствует об отсутствии побочного процесса образования металлсодержащих олигомеров.
В спектре ЯМР 31Р комплекса, полученного на основе несимметричного бис(фосфорилирован-ного) 1,3-дигидрокси)нафталина ^Пб), наблюдаются три сигнала в области ~100 м. д., а также са-теллитные сигналы в области ~44 и ~152 м. д. Это говорит об образовании смеси структурных изомеров с попарным и последовательным соединением фосфорных групп в металлофане. При анализе реакционной смеси методом ТСХ на пластинах БПиМ наблюдалось три пятна одинаковой интенсивности с близкими значениями хромато-графической подвижности ^ 0.6-0.63 в системе бензол-диоксан (3 : 1)).
О расположении фосфорных лигандов в плоскоквадратном комплексе платины в транс-положении свидетельствует величина КССВ Х/Р-Р1 синтезированных комплексов (~3500 Гц), тогда как для аналогичного комплекса на основе бис(фосфори-лированного) резорцина КССВ составляет 5815 Гц, что соответствует цис-изомеру [4]. Вероятно, такая разница в значениях КССВ образующихся комплексов связана с использованием различных исходных соединений платины - Р1(СН3С^2С12 и Р1(ЦОД)С12 (ЦОД = циклооктадиен) соответственно. Для подтверждения данного предположения мы синтезировали комплекс на основе 2,6-бис(тет-раэтилдиамидофосфитокси)нафталина (УГб) и Р1(ЦОД)С12. Действительно, в спектре ЯМР 31Р этого комплекса наблюдается сигнал при 67 м. д. и два сателлитных сигнала в области 18 и 113 м. д. с КССВ Х/Р-Р1 5750 Гц, хактерной для цис-изомера.
В дальнейшем мы решили выяснить, как влияет на ход реакции образовния комплексов и их структуру увеличение расстояния между мостиковыми атомами платины на один нафтиленовый остаток.
С этой целью был использован тионфосфат (XVI). Реакция проходила по следующей схеме:
НО
Б^—Р-О
^2
8 II
о-рхо
М(СНз)2 (XVI)
+ 4Р(№12)3 ОН
СН3СК -4НЖ2*
2Р«(СН3СК)2С12
-2СН3СК
М(СНз)2 (XVII)
о—Р—
№12
2
298
СЛИТИКОВ и др.
Г Tl
Et2N I I |1
Et2N—P-O^^^^^^
Cl—Pt—Cl f^Y^I
Et2N—P-O^^^^^4 NEt2
Через 15 мин от начала бмс(фосфорилирования) в спектре ЯМР 31Р раствора наблюдается два син-глетных сигнала (5 130.6 и 67.0 м. д.) с соотношением интегральных интенсивностей 2 : 1, что свидетельствует об образовании соединения (XVII). После этого из реакционной массы в вакууме удаляли растворитель с диэтиламином, остаток растворяли в CH2Cl2 и вводили Pt(CH3CN)2Cl2. Через 3 ч в спектре ЯМР 31Р реакционной смеси фиксировали два сигнала с 5 67.0 и 98.8 м.д., а также два сателлита. КССВ 1/P_Pt составила 3454.7 Гц, что подтверждает образование транс-изомера. Полученный комплекс (XVIII) после переосаждения гексаном с последующим растиранием представлял собой желтое порошкообразное вещество. Структура комплекса XVIII охарактеризована методом ЯМР 1Н. Интегрирование сигналов показало, что 16 этиль-ных групп принадлежат четырем фосфорным центрам, а четыре метильные - двум другим. Из полученных результатов можно сделать вывод о том, что, как и в случае комплексов XI-XV, мы имеем дело с циклической мостиковой структурой.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все синтезы проводили в безводных растворителях (CH3CN, CH2Cl2, C6H12, пиридин, C6H6), в атмосфере сухого азота. Спектры ЯМР 1Н регистрировали на приборе Bruker АС-200 на частоте 250 МГц (внутренний стандарт - Me4Si) в СDCl3, спектры ЯМР 31Р - на приборе Bruker WP-80SY на частоте 32.4 МГц (внешний стандарт - 85%-ная Н3Р04) в CH2Cl2. Масс-спектры снимали на приборе Reflex III фирмы Bruker, растворитель -CHCl3, матрица - 2,4,6-тригидроксиацетофенон (XI6), 1,2,3,4-тетрагидроантрацен (ХГУа).
Хроматографирование методом ТСХ проводили на пластинах Silufol. Вещества проявляли парами йода и прожиганием.
Гексаметил (ГМТА) и гексаэтилтриамиды (ГЭТА) фосфористой кислоты получали по методу [6], диацетонитрилдихлорид платины(П) - по методу [7], циклооктадиенилдихлорид платины(П) - по методу [8], 9,10-диацетоксиантрацен (III) получали путем восстановительного ацилирования [9], 1,4-диацетоксиантрацен (IV) - аналогичным методом; синтез диантрона (V) осществлен по методу
NEt2 "O—P—NEt2
Cl—Pt—Cl
"O— P—NEt2 NEt2
[10], ди(2-гидрокси-7-нафтил)(диметиламидо)тион-фосфат (XVI) - по методу [11].
Ди-ц-{#мс[(2,6-тетраэтилдиамидофосфито)наф-талин]-#мс[дихлорплатина(П)]} (XI). К 0.098 г (0.4 ммоля) ГЭТА при комнатной температуре и интенсивном перемешивании приливали раствор 0.032 г (0.2 ммоля) 2,6-дигидроксинафталина в 7 мл ацетонитрила. Через 12 мин растворитель быстро отгоняли, полученный маслообразный продукт высушивали в течение 30 мин (50°С, 10 мм рт. ст.); затем продукт растворяли в 10 мл метилендихлорида и при перемешивании добавляли Pt(CH3CN)2Cl2 (0.2 ммоля) или Р^Ц0Д)02, получая соответственно, транс- и цмс-изомеры (XI). Реакционную смесь выдерживали 24 ч, после чего раствор фильтровали, растворитель удаляли в вакууме и полученный продукт переосаждали гексаном. Через сутки раствор над образовавшимся осадком декантировали, вещество растирали с гексаном и сушили в вакууме (2 ч, 1 мм рт. ст., 60°С).
Транс-изомер (Xfo). Выход 88%. Гразл 149-151°C. Rf 0.64 (бензол-диоксан, 5 : 1), 0.91 (хлороформ-этанол (2 : 1)). Спектр ЯМР ХН (5, м. д.): 1.03 т. (48Н, СН3), 3.22 м. (16Н, СН2, 3/PH 10.5 Гц), 3.35 м. (16Н, СН2, 3/PH 12.9 Гц), 7.40-7.66 уш. м. (12Н, СН). ЯМР 31Р (5, м. д.): 100.9 с. (JP Pt 3444.9 Гц). Найдено [m/z]: 1561 (MALDI) QxH^CUNAP^. Вычислено [m/z]: 1549.
Дмс-изомер (XI6). Выход 60%. Маслообразное вещество. ЯМР 31Р (5, м. д.): 67.1 с. (JP-Pt 5750.2 Гц).
Цмс-продукт практически нерастворим в органических растворителях, в отличие от своего транс-аналога, хорошо растворимого в метилен-хлориде, хлороформе и ацетоне.
Комплексы на основе #мс(фосфорилирован-ных) дигидроксиантраценов (общая методика). 0.05 г (0.17 ммоля) диацетоксиантрацена (III, IV) и (0.50 ммоля) ГМТА или ГЭТА интенсивно перемешивали при комнатной температуре в пиридине в течение 6 ч и оставляли на ночь. Через сутки растворитель отгоняли, полученный полупродукт высушивали 3 ч (40°С, 1 мм рт. ст.). Затем соединения (VIII, IX) растворяли в 2 мл метилендихлорида и при перемешивании добавляли 0.059 г (0.169 ммоля) Pt(CH3CN)2Cl2. Реакционную смесь выдерживали 24 ч, после чего раствор фильтро-
N(CH3)2 (XVIII)
вали, растворитель удаляли в вакууме, полученный продукт переосаждали дважды из CH2Cl2 сначала смесью бензол-гексан (1 : 1), затем гексаном. Комплекс (XIIa) высушивали в вакууме 2 ч (1 мм рт. ст., 50°С), комплекс (XIVa) - 4 ч (1 мм рт. ст., 40°С).
Ди-ц-{#мс[(9,10-тетраметилдиамидофос
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.