МИКРОБИОЛОГИЯ, 2013, том 82, № 4, с. 510-512
КРАТКИЕ СООБЩЕНИЯ
УДК 579.2.08
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКАЯ ДЕТЕКЦИЯ МЕТАНОГЕННЫХ АРХЕЙ В ОКИСЛЕННЫХ ВОДАХ ЧЕРНОГО МОРЯ © 2013 г. В. А. Корнеева*, **, 1, А. Л. Брюханов*, **, 2, Н. В. Пименов**
*Московский государственный университет им. М.В. Ломоносова, биологический факультет, каф. микробиологии **Институт микробиологии им. С.Н. Виноградского РАН, Москва Поступила в редакцию 31.01.2013 г.
БО1: 10.7868/80026365613040058
Метаногенные археи традиционно считаются строго анаэробными микроорганизмами. Однако некоторые метаногены, обладая ферментативными механизмами антиокислительной защиты, способны выживать в присутствии низких концентраций кислорода [1] и сохранять свою активность в анаэробных микронишах, образующихся в аэробных местообитаниях (например, в панцирях диатомовых водорослей, фекальных пеллетах копепод и других детритных микрочастицах) [2, 3]. Ранее с применением радиоизотопного метода процесс метаногенеза был обнаружен не только в анаэробных, но и в поверхностных окисленных водах Черного моря [4]. Впервые присутствие жизнеспособных архей в поверхностных водах Черного моря и в зоне хемоклина было показано c помощью флуоресцентной in situ гибридизации (FISH) [5]. Позднее методом FISH в окисленных водах Черного моря показано присутствие физиологически активных метаноген-ных архей подгрупп I (рода Methanobacterium, Methanobrevibacter и Methanosphaera) и II (порядок Methanomicrobiales) [6].
Целью данной работы являлась детекция мета-ногенных архей в окисленной водной толще и в зоне хемоклина Черного моря с использованием ПЦР-анализа.
Пробы воды с глубин от 30 до 200 м отбирали погружным насосом в июле 2010 г. с борта НИС ЮО ИО РАН "Ашамба" на станции с глубиной 1000 м (44°29.85' N, 37°55.24' Е, в 9 милях от Голубой бухты в районе г. Геленджик). Олигонуклео-тидные праймеры [7, 8] для ПЦР ("Синтол", Россия) приведены в таблице. Поскольку известно [2, 3], что метаногенные археи в водной толще могут быть не только свободноживущими, но и ассоциированными с микрочастицами, то для их обнаружения методом ПЦР водные пробы (в количестве 5 л каждая) последовательно фильтровали через крупнопористые стекловолоконные фильтры GF/C и бактериальные фильтры с диаметром пор 0.22 мкм ("Millipore", США). Фильтры хранили в смеси следующего состава: буферный раствор TE (pH 8.0) : этанол (1 : 1) при 4°С. ДНК из растертых в жидком азоте фильтров выделяли с использованием набора Genomic DNA Purification Kit ("Fermentas", Литва). ПЦР-ам-
168 рРНК-специфичные олигонуклеотидные БИН-зонды, меченые флуоресцентным красителем цианином 3, и олигонуклеотидные праймеры для ПЦР, которые использовались в исследовании
ПЦР-праймеры Филогенетическая специфичность Нуклеотидная последовательность (5' ^ 3') Целевой фрагмент 16S рДНК T °С
ARCH344F ARCH915R Archaea ACGGGGTGCAGGCGCGA GTGCTCCCCCGCCAATTCCT 344-360 934-915 57
McrA-F McrA-R Метаногенные археи (ген mcrA, кодирующий а-субъединицу ме-тилкоэнзим-М-редуктазы) GGTGGTGTAGGATTCACACAAT ACGCAACAGC TTCATTGCGTAGTTAGGGTAGTT 52
Met146F Met1324R Метаногенные археи GGCATAACCTCGGGAAAC GCGAGTTACAGCCCACAA 146-163 1341-1324 40
1 2 Авторы для корреспонденции (e-mail: brjuchanov@mail.ru, busenica@yandex.ru).
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКАЯ ДЕТЕКЦИЯ МЕТАНОГЕННЫХ АРХЕЙ
511
плификацию проводили в конечном объеме реакционной смеси 25 мкл (содержащей ~25 нг ДНК-матрицы, 400 мкМ дНТФ ("Fermentas", Литва), 500 нМ каждого праймера ("Синтол", Россия) и 2.5 ед. Taq ДНК-полимеразы) в термоциклере Ge-neAmp PCR System 9700 ("Applied Biosystems", США) при рекомендованных режимах [7, 8].
ДГГЭ для разделения фрагментов гена 16S рРНК архей проводили в 6.5%-ном полиакрила-мидном геле с денатурирующим градиентом от 40 до 60% мочевины и формамида на приборе DCode Universal Mutation Detection System ("BioRad", США) в 0.5х ТАЕ буфере при 60°С и постоянном напряжении 200 В в течение 6 ч. Полученные полосы вырезали из геля, элюировали ДНК в стерильной воде при 4°С, реамплифицировали, а затем очищали из 1%-ного агарозного геля с использованием набора DNA Gel Extraction Kit ("Fermentas", Литва). Очищенную ДНК (5—20 нг) применяли в качестве матрицы для секвенирую-щей реакции с использованием набора BigDye Terminator v3.1 Cycle Sequencing Kit ("Applied Biosystems", США). Секвенирование проводили на приборе 3130 Genetic Analyzer ("Applied Biosystems", США) с 36-см капиллярами и полимером POP6. Полученные нуклеотидные последовательности фрагментов гена 16S рРНК сравнивали с имеющимися последовательностями с использованием программного пакета BLAST.
С помощью ПЦР было показано наличие как ассоциированных, так и свободноживущих архей (праймеры ARCH344 и ARCH915) в водных пробах со всех исследуемых глубин водной толщи Черного моря. С использованием праймеров на ген 16S рРНК (Met146F и Met1324R) свободножи-вущие метаногены обнаруживались на всех глубинах, за исключением 200 м, а ассоциированные представители — на всех глубинах, кроме 100 и 200 м. Однако после ПЦР с более специфичными праймерами на ген mcrA (mcrA-F и mcrA-R) положительный сигнал был выявлен только среди сво-бодноживущих метаногенов на трех глубинах (100, 165 и 180 м).
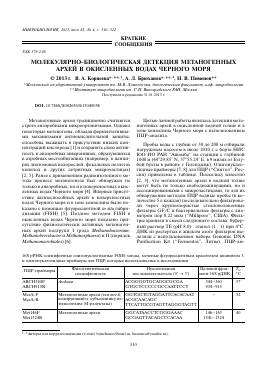
Были получены ДГГЭ профили сообществ архей, которые заметно отличались в разных гидрологических зонах, как по количеству и расположению полос амплифицированных фрагментов гена 16S рРНК архей, так и по их интенсивности (рисунок). Анализ сиквенсов фрагментов гена 16S рРНК, выделенных и реамплифицированных из отдельных ДГГЭ полос, показал следующую максимальную гомологию нуклеотидных последовательностей: для полосы № 1 (30 м, GenBank № JQ732776) — 99% с некультивируемыми представителями морских Thaumarchaeota (семейство Ni-trosopumilaceae) и Crenarchaeota; для полос № 2 (30 м, GenBank № JQ732775), № 4 (30 м, № JQ732773), № 7 (100 м, GenBank № JQ732772), № 10 (145 м,
1 2 3 4 ' 5 6
1 5 12
2 6 15
3 4 * 7 8 9 10 11 13 14 16
ДГГЭ профиль сообществ архей из верхней водной
толщи Черного моря (1—6 — образцы ДНК с глубин
30, 100, 145, 165, 180 и 200 м соответственно).
ОепВапк № JQ732770), № 11 (165 м, ОепВапк № JQ732769) — 98—99% с некультивируемыми морскими Crenarchaeota; для полосы № 3 (30 м, ОепВапк № JQ732774) — 99% с некультивируемыми представителями морских архей; для полосы № 8 (100 м, ОепВапк № JQ732771) - 98% с некультивируемыми Thaumarchaeota. Результаты ДГГЭ свидетельствуют о том, что в кислородсодержащей водной толще и хемоклине Черного моря доминируют некультивируемые крен- и та-умархеи, а метаногены, составляющие, по всей видимости, минорную часть, не выявляются с использованием праймеров, специфичных к участкам гена 168 рРНК домена Archaea.
Авторы выражают благодарность к.г.н. Часов-никову В.К. и д.ф.-м.н. Якушеву Е.В. из лаборатории химии моря Южного отделения Института океанологии им. П.П. Ширшова РАН за помощь при отборе черноморских водных проб, а также к.б.н. Кизиловой А.К. из Института микробиологии им. С.Н. Виноградского РАН за содействие в проведении ДГГЭ.
МИКРОБИОЛОГИЯ том 82 № 4 2013
512
КОРНЕЕВА и др.
СПИСОК ЛИТЕРАТУРЫ
1. Брюханов А.Л., Нетрусов А.И. Аэротолерантность строго анаэробных микроорганизмов: факторы защиты от окислительного стресса // Прикл. биохимия и микробиология. 2007. Т. 43. № 6. С. 637—654. Brioukhanov A.L., Netrusov A.I. Aerotolerance of strictly anaerobic microorganisms and factors of defense against oxidative stress // Appl. Biochem. Microbiol. A Review // 2007. V 43. № 6. P. 567-582.
2. Bianchi M., Marty D., Teyssie J.L., Fowler S.W. Strictly aerobic and anaerobic bacteria associated with sinking particulate matter and zooplankton fecal pellets // Marine Ecol. - Progress Series. 1992. V. 88. P. 55-60.
3. Fuchsman C.A., Kirkpatrick J.B., Brazelton W.J., Murray J.W., Staley J.T. Metabolic strategies of free-living and aggregate-associated bacterial communities inferred from biologic and chemical profiles in the Black Sea suboxic zone // FEMS Microbiol. Ecol. 2011. V. 78. № 3. P. 586-603.
4. Русанов И.И., Юсупов С.К., Пименов Н.В., Леин А.Ю., Иванов М.В. Микробное образование метана в аэробной зоне Черного моря // ДАН. 2004. Т. 399. № 4. С. 571-573.
Rusanov I.I., Yusupov S.K., Savvichev A.S., Lein A.Yu., PimenovN.V., IvanovM.V. Microbial methane generation in aerobic water column of the Black Sea // Dokla-dy Biol. Sci. 2004. V. 399. № 1-6. P. 493-495.
5. Пименов Н.В., Русанов И.И., Юсупов С.К., Фридрих Я., Леин А.Ю., Верли Б., Иванов М.В. Микробиологические процессы на границе аэробных и анаэробных вод в глубоководной зоне Черного моря // Микробиология. 2000. Т. 69. № 4. С. 527-540. Pimenov N.V., Rusanov I.I., Yusupov S.K., Fridrich J., Lein A.Yu., Wehrli B., Ivanov M.V. Microbial processes at the aerobic-anaerobic interface in the deep-water zone of the Black Sea // Microbiology. 2000. V. 69. № 4. P. 436-448.
6. Pimenov N.V., Bryukhanov A.L., Korneeva V.A., Zakharova E.E., Sigalevich P.A., Rusanov I.I., Yakush-ev E.V., Chasovnikov V.K. Anaerobic microbial community in the aerobic water and at the oxic/anoxic interface in the Black Sea // Chemical Structure of Pelagic Redox Interfaces: Observation and Modelling. Handbook of Environmental Chemistry Series / Ed. Yakushev E.V. Berlin, Heidelberg: Springer-Vsrlag, 2013. V. 22. P. 27-46.
7. Marchesi J.R., Weightman A.J., Cragg B.A., Parkes R.J., Fry J.C. Methanogen and bacterial diversity and distribution in deep gas hydrate sediments from the Cascadia Margin as revealed by 16S rRNA molecular analysis // FEMS Microbiol. Ecol. 2001. V 34. № 3. P. 221-228.
8. Luton P.E., Wayne J.M., Sharp R.J., Riley P.W. The mcrA gene as an alternative to 16S rRNA in the phyloge-netic analysis of methanogen populations in landfill // Microbiology (UK). 2002. V 148. № 11. P. 3521-3530.
МИКРОБИОЛОГИЯ том 82 № 4 2013
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.