Письма в ЖЭТФ, том 93, вып. 2, с. 92-94
© 2011 г. 25 января
Обнаружение в воде неравновесных фазовых переходов
Л. Н. Батуров, И. Н. Говор1), А. С. Обухов*, В. Г. Плотниченко+, Е. М. Дианов+
ФГУП Всероссийский научно-исследовательский институт физико-технических и радиотехнических измерений
141570 Менделеево, Московская обл., Россия
+ Научный центр волоконной оптики РАН, 119333 Москва, Россия
* ЗАО НТЦ Экспертцентр, 141570 Менделеево, Московская обл., Россия
Поступила в редакцию 23 ноября 2010 г. После переработки 9 декабря 2010 г.
При исследовании зависимости температуры дистиллированной воды от времени при ее охлаждении и нагреве в диапазоне температур от 3 до 5°С обнаружены неравновесные фазовые переходы, что свидетельствует о наличии в воде упорядоченных надмолекулярных структур.
Нами исследовались зависимости температуры Т дистиллированной воды (удельная проводимость 4мкСм/см) от времени t при ее охлаждении и нагреве. При температурах ниже 5°С были обнаружены процессы аномальных поглощений и выделений энергии, предварительное изучение и интерпретация которых и явились содержанием данной работы.
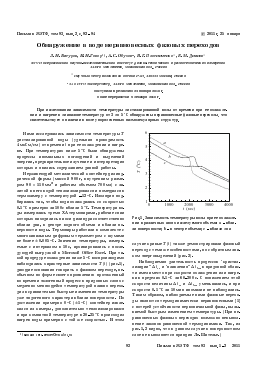
Нержавеющий металлический контейнер цилиндрической формы (массой 900 г, внутренним размером 90 х 110 мм2 и рабочим объемом 700 мл) с залитой в него водой теплоизолировался и помещался в термокамеру с температурой ^12 °С. Изоляция подбиралась так, чтобы вода охлаждалась со скоростью 0.1 °С примерно за 100 с вблизи 5°С. Температура воды измерялась тремя ХА термопарами, рабочие спаи которых находились на оси цилиндра соответственно вблизи дна, в центре водного объема и вблизи поверхности воды. Термопары работали в комплекте с многоканальным цифровым термометром с шумами не более ±0.005 °С. Значения температуры, измеряемые с интервалом в 10с, архивировались с последующей выгрузкой в Microsoft Office Excel. При такой процедуре охлаждения ниже 5 °С воспроизводимо наблюдались характерные зависимости T(t) (рис.1), дающие основания говорить о фазовом переходе, необычном по форме своего проявления: протяженный во времени экзогенный процесс в придонных слоях с медленно меняющейся температурой плавно переходил в сравнительно быстрые изменения температуры уже эндогенного характера вблизи поверхности. По достижении примерно 0°С (±1°С) контейнер извлекался из камеры, дополнительно теплоизолировался и при комнатной температуре в 20-25 °С происходил нагрев воды примерно с той же скоростью. В этом
U
о
4 -
^e-mail: test-center®vniiftri.ru
_i_I_I_I_I_I_I_I_I_I_I_I_I_I_I_I_i_
"0 1000 2000 3000 4000 t (sec)
Рис.1. Зависимость температуры воды при ее охлаждении в различных слоях исследуемого объема: a - вблизи поверхности; Ъ - в центре объема; с - вблизи дна
случае кривые Т(1) также демонстрировали фазовый переход с теми же особенностями, но с обратным знаком энерговыделений (рис.2).
Наблюдаемая длительность процессов "кристаллизации" А1С1 и "плавления" в придонной области имела место при скорости охлаждения или нагрева в пределах 0.1 °С за 60-200с. С понижением этой скорости величины А1С1 и Д£йд8 уменьшались, и при скорости 0.1 °С за 10 мин аномалии не наблюдались. Таким образом, наблюдаемые нами фазовые переходы являются термодинамически неравновесными [1] с потерей устойчивости первоначальной фазы, вызываемой быстрым изменением температуры. (При неравновесных фазовых переходах возможно невыполнение законов равновесной термодинамики. Так, из рис.1,2 видно, что в данном случае в поверхностном слое не выполняется принцип Ле-Шателье.)
6
5
3
2
Обнаружение в воде неравновесных фазовых переходов
93
U
о
a b c
-
- I , I I i i i i i i i i i i ¡¡lili
1000 2000 3000 t (sec)
4000
Рис.2. Зависимость температуры воды при ее нагреве в различных слоях исследуемого объема: а - вблизи поверхности; Ъ - в центре объема; с - вблизи дна
Как видно из рис.1с, вид кривой Т(1) вблизи дна совпадает с подобной зависимостью, наблюдаемой при фазовых переходах 1-го рода, что позволяет легко оценить величину удельной скрытой энергии фазового перехода в придонных слоях воды. Ширина перехода в этих слоях - 0.1 °С, и поэтому величина избыточной энергии пропорциональна коэффициенту к = (Д*сг/Д*соо1) — гДе Д*соо1 _ интервал времени, требуемый для охлаждения воды на 0.1 °С и вычисляемый из зависимостей Т(1) вне аномалии. Тогда величина искомой энергии на 1 г придонной воды равна Е = 0.1 кС = 4.2Дж/г (при к = 10 и С = 4.2 Дж/г-град) или 1.25% от удельной энергии плавления льда. Энергия примерно такой же величины наблюдается при фазовых переходах и при нагреве. Однако в отличие от классических фазовых переходов 1-го рода, в рассматриваемых переходах величина скрытой энергии оказалась величиной не постоянной. На рис.3 дано сравнение кривых Т(1) для придонных слоев, полученных при охлаждении воды объемом 700 и 450 мл в одном и том же контейнере. Оказалось, что в последнем случае значение А1С1 примерно в два раза меньше, коэффициент к = 4.8 и, соответственно, Е = 2 Дж/г. Дополнительные опыты показали, что значения А1С1, а с ней и значения Е, увеличиваются с ростом высоты столба исследуемой воды и, по крайней мере, в первом приближении не зависят от ее объема.
Отметим, что все указанные явления не зависели от материала контейнера (пластик, стекло, металл) и от величины проводимости воды (до бООмкСм/см). Какой-либо зависимости величин Д£сг и Д££и5 от вре-
U
о
3 -
_I_I_I_I_I_I_I_I_I_I_I_L_
1000 2000 t (sec)
J_I_L_
3000
Рис.3. Длительность фазового перехода вблизи дна для разных объемов воды: а - 700 мл; Ъ - 450мл
мени хранения дистиллированной воды (от 4ч до трех месяцев) не наблюдалось.
Таким образом, в ходе воспроизводимых экспериментов ниже 5°С впервые2^ обнаружено аномальное поведение воды и естественно предположить, что связано оно с фазовыми превращениями в ее упорядоченных надмолекулярных структурах, существование которых является ее "врожденным" свойством, и с временами жизни, никак не меньше длительности процессов "кристаллизации" AtCI и "плавления" Aífus, наблюдаемых в придонной области, а это более тысячи секунд. (Отметим, что в известных к настоящему времени экспериментальных работах [3 -6] приводятся результаты, указывающие на наличие в воде надмолекулярных структур, но все они получены при внешних воздействиях на воду).
Для объяснения характеристик наблюдаемых фазовых переходов и их наличия именно в диапазоне температур от 3 до 5 °С требуются дальнейшие, более широкие, исследования. Одно из возможных направлений таких исследований - проверка связи наблюдаемых нами явлений с развиваемыми в [7] представлениями о долгоживущих надмолекулярных структурах, в основе которых лежат льды высоких давлений VI, VII и VIII. Действительно, согласно теории [1], фазовые неустойчивости возникают вблизи критических точек на фазовой диаграмме состояний рассматриваемой системы. В нашем случае - это Р^Т-диаграмма воды, на которой критические температурные точки в диапазоне от 3 до 5°С для жидкой
2Шо крайней мере, в недавнем фундаментальном обзоре [2] литературных данных о структурной гетерогенности чистой жидкой воды ничего подобного не рассматривалось.
5
4
2
0
0
94
Л. Н. Батуров, И. Н. Говор, А. С. Обухов, В. Г. Плотниченко, Е. М. Дианов
воды при нормальных условиях, как известно, отсутствуют. Но именно в этом диапазоне температур на той же диаграмме имеется тройная точка Ttr для льдов VI, VII, VIII (при 5°С по данным [8]), а кривая, разделяющая льды VII и VIII, с повышением давления плавно уходит от Ttr в сторону более низких температур. Такое совпадение наших данных с теоретическими выводами из [7] дает серьезные основания для рассмотрения их в качестве рабочей гипотезы.
Наконец отметим, что предварительные эксперименты с тяжелой водой также показали наличие в ней схожих аномалий в диапазоне температур от 9 до 12 °С. Примечательно, что интервалы температур, в которых наблюдаются фазовые переходы, включают в себя те значения, при которых у НгО и D2O имеется максимум плотности (вблизи 4 и 11 °С соответственно).
1. Ю. А. Климонтович, Введение в физику открытых систем, М.: Янус-К, 2002.
2. Roy Rustum, W. A. Tiller, Iris Bell, and M.R. Hoover, Materials Research Innovations 9, issue 4, 577 (2005).
3. В. И. Лобышев, Б. Д. Рыжиков, Р. Э. Шихлинская, Вестник МГУ, сер. "Физика" 36, 48 (1995).
4. М. В. Березин, Г. Н. Зацепина, В. Ф. Кисилев, А. М. Са-лецкий, Журн. физ. химии 65, 1338 (1991).
5. В. В. Гончарук, В. Н. Смирнов, А. В. Сыроешкин, В. В. Маляренко, Химия и технология воды 29, 3 (2007).
6. G.S. Anagnostatos, P. Pissis, and К. Viras, Atomic and Nuclear Clusters, Eds.: G.S. Anagnostatos, W. Von Oertzen, Springier-Verlag, Heidelberg, 1995, p. 215.
7. А. А. Стехин, Г. В. Яковлева, Структурированная вода. Нелинейные эффекты, М.: ЛКИ, 2008.
8. D. Eisenberg, W. Kauzmann, The Structure and Properties of Water, Oxford University Press, London, 1969.
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.