ПОВЕРХНОСТЬ. РЕНТГЕНОВСКИЕ, СИНХРОТРОННЫЕ И НЕЙТРОННЫЕ ИССЛЕДОВАНИЯ, 2008, № 12, с. 85-89
УДК 535.34
ОПРЕДЕЛЕНИЕ ЛОКАЛЬНОЙ АТОМНОЙ СТРУКТУРЫ АКТИВНОГО ЦЕНТРА БЕЛКА БРОМПЕРОКСИДАЗЫ НА ОСНОВЕ АНАЛИЗА СПЕКТРОВ РЕНТГЕНОВСКОГО ПОГЛОЩЕНИЯ
© 2008 г. А. В. Костенко1, М. Фейтерс2, А. Н. Кравцова1, А. В. Солдатов1
1Южный федеральный университет, Ростов-на-Дону, Россия 2Радбаудский университет, Неймеген, Нидерланды Поступила в редакцию 17.03.2008 г.
Проведено уточнение существующей модели активного центра белка бромпероксидазы (BPO), полученной на основе методов дифракционного анализа. Исследованы процессы, происходящие в активных центрах этого белка при взаимодействии с перекисью водорода. Показано, что существующая модель активного центра бромпероксидазы не является достаточно точной. Для проверки реалистичности определенных структурных параметров локального активного центра в этом белке был использован метод оптимизации атомарной структуры на основе теории функционала электронной плотности. Предложена новая модель активного центра исследуемого белка.
ВВЕДЕНИЕ
МЕТОДИКА РАСЧЕТА
Белок бромпероксидаза (ВРО) относится к группе ванадийсодержащих протеинов (галопер-оксидаз), способных окислять галогениды (С1-, Вг-, I-) в присутствии пероксида водорода до соответствующих гипогалогенных кислот [1]:
Н2О2 + X- + Н+ = Н2О + НОХ.
■2^
Протеины данной группы чаще всего получают из морских водорослей (например, Ascophyl-lum nodosum), либо наземных мхов (Curvularia inaequalis). Многие соединения, которые могут быть получены с помощью данных протеинов, бактерицидны и, соответственно, имеют важное значение для защитных функций организма. Понимание принципов работы активного центра BPO чрезвычайно важно для использования данного соединения как сильного катализатора в химическом производстве индустриального масштаба. Исследование тонкой структуры спектров рентгеновского поглощения вблизи края (XANES) в сочетании с другими методами дает точное представление о локальной атомной структуре активного центра белка и позволяет получить информацию о природе протекающей в нем реакции. Пероксид водорода является активатором белка бромпероксидазы в реакциях с галогенидами. О механизме взаимодействия пероксида с активным центром белка в настоящее время ведутся дискуссии. Данная работа является частью большого проекта, цель которого - выяснить детали этого процесса.
В настоящей работе был проведен теоретический анализ нескольких экспериментальных XANES-спектров K-края атома ванадия, соответствующих различным состояниям активного центра рассматриваемого соединения. Наиболее характерными экспериментальными спектрами являются XANES-спектры поглощения атома ванадия из белка BPO (полученного из Ascophyllum nodosum) в присутствии пероксида водорода и без
Амплитуда
A1 B C
5500
5550
5600 Энергия, эВ
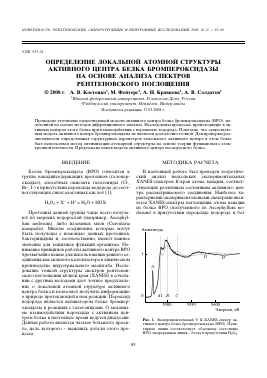
Рис. 1. Экспериментальный V ^-ХАМЕБ-спектр активного центра белка бромпероксидазы (ВРО). Пунктирная линия соответствует обычному состоянию ВРО, непрерывная линия - белку в присутствии Н2О2.
1
0
86
КОСТЕНКО и др.
Рис. 2. Активный центр белка BPO, состоящий из атома ванадия, координированного четырьмя атомами кислорода и связанного с кольцом имидазола.
него (рис. 1). Экспериментальные V ä-XANES-спектры были получены на EXAFS-станции Европейской молекулярно-биологической лаборатории (EMBL) в Гамбурге (Германия). Был использован двойной монохроматор Si( 111), установленный на 50% от пиковой интенсивности, а также 13-элементный флуоресцентный детектор CANBERRA. Для измерения в режиме флуоресценции детектор был установлен в горизонтальной плоскости под углом 90° к лучу. Образец был установлен под углом 45° к лучу, для каждого образца было выполнено 50-80 измерений. Измерения производились при температуре 20 K в гелиевой атмосфере в криостате закрытого цикла. Накопительное кольцо DORIS III было в режиме 4.5 ГэВ при токе 85-140 мА.
В качестве исходных моделей атомного строения активного центра рассматривались четыре структуры, полученные из экспериментов по рентгеновской дифракции для белков хлорперок-сидазы и бромпероксидазы (CPO и BPO) [2]. Оба белка имеют очень близкую структуру, и потому все четыре модели могут быть использованы в качестве начального приближения для построения структуры белка BPO (рис. 2):
1qi9.pdb - BPO из Ascophyllum nodosum; 1idu.pdb - CPO + H2O2 из Curvularia inaequalis;
1idq.pdb - CPO из Curvularia inaequalis;
1vnc.pdb - CPO из Curvularia inaequalis;
Во всех моделях активный центр представлен атомом ванадия, который координирован четырьмя атомами кислорода и связан с имидозоль-ным кольцом. Атомы кислорода расположены приблизительно в вершинах тетраэдра.
Теоретические спектры XANES были рассчитаны в теории полного многократного рассеяния в маффин-тин-потенциале, реализованной в про-
Энергия, эВ
Рис. 3. Сравнение экспериментальных V ^-ХАМЕБ-спектров белка ВРО с теоретическими. Верхняя пара спектров рассчитана в РЭММЕ82007 без применения "размазки", нижняя пара рассчитана в РЕРР8.4. Сплошные линии теоретических спектров соответствуют исходным структурам, пунктирные - структурам после применения геометрической оптимизации.
грамме РЕРР8.4 [3]. Так как рассматриваемая структура плохо описывается в приближении маффин-тин потенциала, при расчете здесь следует ожидать определенных погрешностей. Для проверки применимости модели маффин-тин-по-тенциала были проведены расчеты, основанные на более ресурсоемком методе конечных разностей в полном потенциале, реализованном в программе РБММЕ82007 [4]. Сравнение теоретических спектров, рассчитанных в рамках этих двух подходов, показывает, что в расчетах в маффин-тин потенциале плохо передаются структуры, находящиеся близко к краю поглощения (рис. 3). Тем не менее, основная часть спектра хорошо передается при расчетах, выполненных с использованием программного кода РЕРР8.4, что позволяет активно использовать данный подход в нашем анализе. В расчетах РЕРР использовался обменный потенциал типа Хедина-Ландквиста. Число атомов, использованных в расчете, составляет порядка 180 (радиус кластера - 7.5 А). Самосогласование электронной плотности и потенциала выполнялось в кластере радиусом 4 А. Расчеты методом конечных разностей были выполнены для атомных кластеров радиусом 4.5 А. Геометрическая оптимизация проводилась на основе теории функционала электронной плотности (БРТ), реализованного в программном пакете АБР2007 [5], а также полуэмпирического квантово-механиче-ского подхода МОРАС [6] и подхода молекулярной механики ММ3-уровня [7].
ОПРЕДЕЛЕНИЕ ЛОКАЛЬНОЙ АТОМНОЙ СТРУКТУРЫ
87
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для модели ^9.рёЪ был проведен анализ влияния малых изменений геометрии активного центра на теоретический спектр. Под изменением геометрии понимаются вариации структурных параметров, которыми здесь являются длины связей атома ванадия с атомами кислорода, находящимися в экваториальной плоскости ^-Огаё), с атомом кислорода, лежащим на оси атомов М-^О ^-Оах), а также расстояние до имидозольного кольца ^-М) и соответствующие углы между химическими связями. Наиболее важны в данном случае длины связей V-O и ^М, в то время как углы между связями, а также расстояния до атомов из более далеких координационных сфер слабее влияют на ХАКЕБ-спектр ванадия. Анализ влияния изменения структурных параметров на ХАМЕБ-спектры производился с использованием метода многомерной интерполяции спектров, реализованного в программном пакете БкЫ.О [8]. В результате варьирования основных структурных параметров была предложена структура, теоретический спектр которой больше соответствует экспериментальному, чем спектр, рассчитанный для исходной модели Ц19.рёЪ (табл. 1, рис. 4). Данная структура хорошо соответствует структуре, полученной методом геометрической оптимизации, который будет описан далее.
Амплитуда 2.1
1.8
1.5 1.2 0.9 0.6
B
- A1 C D
" a J: 1 IIя \ ■ ■
tlll¥j ii IIя If 1 i ■ и" / ■ HI" /Iя 1/1" J
I ^ 1 \"jl 1 i 1
5450
5500
5550
5600 Энергия, эВ
Рис. 4. Сравнение экспериментального V ^-ХАМЕБ-спектра белка ВРО с теоретическими, полученными для исходной модели Ц19.рёЪ и модели, прошедшей оптимизацию, а также для модели, полученной вариацией структурных параметров. Жирной линией обозначен экспериментальный спектр ВРО, тонкой линией - спектр оптимизированной с помощью АЭБ-структуры, пунктирной линией - спектр модели, найденной с помощью вариации структурных параметров; квадратиками обозначен теоретический спектр исходной модели.
Таблица 1. Основные структурные параметры исходной модели ^9.рёЬ и модели, выбранной после варьирования данных параметров
Межатомные расстояния, А 1qi9 начальный 1qi9 оптимальный
V-Oax 1.77 1.95
V-Orad1 1.59 1.75
V-Orad2 1.6 1.75
V-Orad3 1.52 1.67
V-N 2.11 2.11
Для каждой модели была решена задача по поиску геометрии с минимальной полной энергией как с помощью квантово-механических методов (DFT, MOPAC), так и с помощью методов молекулярной механики (ММ). При применении MM-подхо-да оптимизация применялась ко всем атомам белка (около 5000 атомов), в квантово-механических расчетах MOP AC и DFT использовался кластер атомов, составляющих активный центр, радиусом 7 А (~170 атомов). Координаты атомов, находящихся в кольце от 5 до 7 А, были заморожены.
Можно показать, что для данного соединения форма XANES-спектра за K-краем ванадия зависит прежде всего от атомов, находящихся на расстоянии не более 3 А от поглощающего, т.е. внешние по отношению к ним атомы тоже участвуют в процессе многократного рассеяния, но небольшие изменения относительных положений этих атомов мало влияют на спектр (рис. 5).
Амплитуда
5450
5500
5550
5600 Энергия, эВ
Рис. 5. Теоретические V ^-ХАМЕБ-спектры для модели 1упе.рёЪ в начальном виде(жирная линия), после геометрической оптимизации АЭБ (тонкая линия) и после подстановки оптимизированного кластера радиусом эА в начальную структуру (пунктир).
88
КОСТЕНКО и др.
Таблица 2. Структурные параметры рассматриваемых моделей в исходном состоянии и после применения различных подходов оптимизации структуры
1019 11Б0 1гои 1УЫС
Ме
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.