ГЕОХИМИЯ, 2007, № 2, с. 237-240
КРАТКИЕ СООБЩЕНИЯ
ТЕПЛОЕМКОСТЬ И ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ ЭПСОМИТА
MgS04 • 7Н20(К) В ОБЛАСТИ 0-303 К © 2007 г. В. М. Гуревич*, О. Л. Кусков*, К. С. Гавричев**, А. В. Тюрин**
*Институт геохимии и аналитической химии им. В.И. Вернадского РАН 117975 Москва, ул. Косыгина, 19 **Институт общей и неорганической химии им. Н.С. Курнакова РАН 119991 Москва, Ленинский просп., 31 Поступила в редакцию 14.04.2006 г.
Геолого-геофизические данные, полученные зондом "Галилео" во время облетов вокруг спутников Юпитера, свидетельствуют о возможном наличии под твердой ледяной корой жидкого водного слоя (в земных терминах - морской воды или океана) мощностью от нескольких десятков (Европа) до нескольких сотен (Ганимед и Каллисто) километров [1-2]. Предположительно океаны Европы, Ганимеда и Каллисто представляют собой растворы электролитов при высоких давлениях. Наличие воды привело к гипотезе о возможном существовании примитивных форм внеземной жизни в приповерхностном океане. Материал внешнего слоя ледяных спутников Юпитера состоит в основном изо льда Н20, загрязненного темной, не ледяной компонентой (типа вещества углистых хондритов). Спектральные данные зонда "Галилео" указывают на присутствие смесей кристаллогидратов солей (MgSO4 • пН20, • пН20 и других) на ледяной поверхности спутников [3].
Для разработки моделей современного состава океанов необходимы термодинамические и теплофизические данные по кристаллогидратам сульфатов и карбонатов магния и натрия, спектрально наблюдаемых на ледяной поверхности спутников. С этой целью проведено экспериментальное определение низкотемпературной теплоемкости эпсомита MgSO4 • 7Н20(к).
Измерение теплоемкости. В качестве образца использован сульфат магния гептагидрат квалификации ОСЧ (сумма примесей <5 х 10-3%). Образец представлял собой белый кристаллический порошок с величиной зерен от нескольких десятых до 1 мм. Рентгено-фазовый и дифференциально-термический анализы в пределах чувствительности метода показали, что он состоит из эпсомита. Перед измерением эпсомит выдерживался в эксикаторе над насыщенным раствором №С1 до приобретения постоянного веса. Химический анализ (MgO - 16.50, SO3 - 32.78, Н20- - 36.58 и Н20+ - 14.14%) показал не-
сколько заниженное содержание воды (6.868Н20) по сравнению с теоретическим составом (7Н20). Молекулярная масса исследованного образца (MgSO4 • • 6.868Н20) - 244.091 г моль-1.
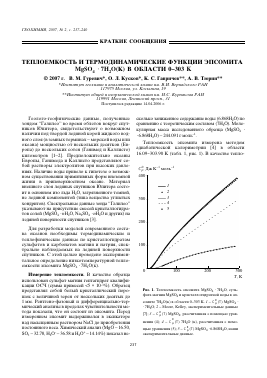
Теплоемкость эпсомита измерена методом адиабатической калориметрии [4] в области 16.09-303.90 К (табл. 1, рис. 1). В качестве тепло-
С°р, Дж К-1 моль-1 400
300 -
200-
100
100
200
300 T, K
Рис. 1. Теплоемкость эпсомита MgSÜ4 • 7H2O, сульфата магния MgSÜ4 и кристаллогидратной воды в эп-
сомите 7H2Ü(k) в области 0-303 К. 1 - C°p (T) MgSO4 • • 7H2O; 2 - Moore, Kelley, экспериментальные данные
[7]; 3 - C°p (T) MgSÜ4, рассчитанная с помощью уравнения (4); 4 - C°p (T) 7H2O (к), рассчитанная с помощью уравнения (5); 5 - C°p (T) MgSO4 • 6.868H2O, наши экспериментальные данные.
0
Таблица 1. Экспериментальные значения теплоемкости эпсомита - MgSO4 ■ 6.868Н20(к)
Т, К С0 Ср, ДжК-1моль-1 Т, К С0 Ср, ДжК-1моль-1 Т, К С0 Ср, ДжК-1моль-1 Т, К С0 Ср, ДжК-1моль-1
16.09 4.661 62.66 86.26 118.77 170.18 205.13 276.04
17.04 5.237 64.71 89.84 122.23 175.13 209.19 281.20
19.12 7.966 66.75 92.98 125.61 179.72 213.22 285.87
20.49 10.12 68.79 96.50 128.58 183.31 217.25 290.34
21.95 11.99 70.82 99.75 131.56 187.08 221.32 294.98
23.42 14.19 72.83 103.19 134.54 191.01 225.39 299.68
24.64 15.90 74.84 106.37 137.53 194.67 229.47 303.90
25.80 17.83 76.84 109.64 139.08 197.18 233.56 308.46
26.83 19.49 78.85 113.45 142.43 201.18 237.65 313.32
28.01 21.67 80.96 116.56 145.55 205.20 241.63 317.48
29.34 23.81 82.96 119.94 148.60 208.90 245.49 320.96
31.11 27.22 84.96 122.81 151.86 213.04 249.37 325.05
33.31 31.29 86.96 125.25 155.13 217.11 253.37 329.85
35.82 35.93 88.96 128.43 158.00 219.87 257.84 334.70
38.66 41.34 90.96 131.49 160.62 224.01 262.93 340.24
41.28 46.35 92.97 134.85 163.66 227.77 268.03 346.62
43.82 51.72 94.99 137.54 166.95 231.53 273.15 351.66
46.50 56.45 97.00 140.23 170.24 235.61 278.25 357.03
49.16 61.37 99.05 143.05 173.55 239.30 283.36 362.30
51.59 66.47 101.11 146.26 177.20 243.71 288.47 367.18
51.73 66.36 103.13 148.84 181.35 248.46 293.61 373.00
53.97 70.57 105.16 151.60 185.19 253.21 298.76 378.21
54.21 71.19 107.18 155.08 189.21 257.94 303.90 385.06
56.26 74.47 109.09 157.00 193.24 262.83
58.44 78.57 112.13 161.11 197.27 267.67
60.57 82.40 115.36 166.12 201.20 271.85
Таблица 2. Коэффициенты полинома (1) Ср (Т) =
= Ъ" ==0 А1 [1-ехр(-0.0017)У (эпсомит MgSO4 ■ 6.868Н20(к); температурный интервал: 16.09-303.90 К)
1 А, Дж К 1 моль 1 1 А,, Дж К 1 моль 1
0 0.4727 х 101 5 -0.1288354 х 109
1 -0.151449 х 104 6 0.453751783 х 109
2 0.1236951 х 106 7 -0.87802457 х 109
3 -0.219984126 х 107 8 0.7191021 х 109
4 0.217693393 х 108
обменного газа использован гелий при давлении ~1 бар. Величина навески - 1.5749 г.
Определение теплоемкости эпсомита MgSO4 х
х 7Н20(к). Экспериментальные данные по С°р (Т) М§Б04 ■ 6.868 Н20 сглажены полиномом согласно алгоритму, изложенному в [5-6]:
Ср(Т)Ме804 • 6.868Н20 =
т
= Ъ А, [ 1-ехр (-0.001Т)]1.
1 = о
(1)
Величины коэффициентов А, приведены в табл. 2.
Чтобы перейти от теплоемкости реального образца к теплоемкости эпсомита теоретическо-
ТЕПЛОЕМКОСТЬ И ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ ЭПСОМИТА 239
го состава в ходе расчетов делались следующие допущения:
1. При небольших отклонениях от стехиометрии (в нашем случае 0.132 Н20) имеет место равенство:
Таблица 3. Параметры уравнений (4) и (5)
СР (т) ыв804 • 7Н2О =
(2)
= С0р(т)Ые8О4 • 6.868Н2О + О.132С0Р(Т)Н2О(к),
где С° (Т)Н20(к) - теплоемкость одного моля кри-сталлогидратной воды в эпсомите;
2. Теплоемкость одного моля кристаллогид-ратной воды в эпсомите:
С0р( Т)Н2О (к) = = [Ср(Т)Ыв8О4 • хН2О - СО(Т)ЫВ804]/х,
(3)
= п
С°р (Т) ЫВ804 (к) =
3
(1/3)£ аР (° 1 / Т) + а4 Е (0Е/Т)
1 = О
(4)
+ п
(1/3)2 аРз (01/Т) + а4 Е (0 Е /Т) +
1 = 1
+ а5 К10, /Т,0„ /Т
(5)
где х - количество молекул воды в эпсомите; для исследованного образца х = 6.868.
Данные по теплоемкости сульфата магния приняты из работы [7], в которой область измерений
С°р (T)MgSO4 ограничена интервалом 53.30-295.40 К.
Чтобы получить зависимость С°р (Т) MgSO4 в промежутке 0-303 К, экспериментальные данные [7] были аппроксимированы уравнением DE [8]:
Параметры Величины параметров
Уравнение(4) Уравнение (5)
а0, Дж-1 моль - 1.4689 х 10-5
а1 0.98533 0.33333
а2 0.98383 0.33333
а3 0.98933 0.33333
а4 0.01583 0.33333
а5 - 0.33333
01, К 343 171
02, К 837 287
03, К 1712 671
0E, К 472 2047
0ь, К - 484
0№ К - 1444
где п - число атомов в молекуле вещества (для MgSO4 п = 6); D и Е - дебаевская и эйнштейновская функции; 0Ь 02 , 03, 0Е, - характеристические температуры; ах, а2, а3 , а4, - линейные коэффициенты. Величины параметров ах, ..., а4, 0Х, ..., 0Е, определенные нелинейным МНК, приведены в табл. 3. Методика расчета параметров подробно изложена в [8]. С помощью уравнения (4) рассчитаны теплоемкость сульфата магния при 0-303 К,
и на основании формулы (3) - С°р (Т)Н20(к) в интервале 16.09-303.90 К.
Полученная зависимость Ср (Т)Н20(к) аппроксимирована уравнением ADEK:
Ср( Т)Н2О (к) = арТ (Сг )2 +
где п = 3; К - К-функция Киффер [9]; 0£, 0У - характеристические температуры К-функции; а5 -линейный коэффициент; функция СУ(Т) имеет
следующий вид: С^ = п[(1/3) 2а (03/Т) +
з = 1
+ а4Е(0Е/Т) + а5К(0£/Т, 0„/Т)]. Аббревиатура АББК означает, что зависимость (5) представляет собой сумму, состоящую из члена а0Т(Сг)2 (вклад работы расширения решетки), трех дебаевских, одной эйнштейновской и одной К-функций. Формирование сумм Б-, Е-, К-функций типа уравнения (5) и их использование для аппроксимации зависимости С°р (Т) описано в [10].
Так же, как и в случае уравнения (4), величины параметров а0, ..., а5, 0Х, ... , 0У определены нелинейным МНК; значения приведены в табл. 3. Уравнение (5) использовано для оценок теплоемкости кристаллогидратной воды в эпсомите Н20(к) в последующих расчетах.
С помощью уравнения (2) рассчитана теплоемкость и затем определены значения энтропии и изменения энтальпии MgSO4 • 7Н20(к) в области 0-303 К (табл. 4). При 298.15 К эти функции имеют следующие значения:
С0р (Т)(298.15 К) = 383.43 ± 0.29 Дж К-1 моль-1, ^(298.15 К) = 375.47 ± 0.18 Дж К-1 моль-1, #°(298.15К) - Я°(0 К) = 60.098 ± 0.017 кДж моль1.
Указанные неопределенности представляют собой случайные ошибки.
Полученное значение ^(298.15 К) = 375.47 ± ± 0.18 Дж К-1 моль-1 хорошо согласуется с данными справочника [11]: ^(298.15 К) = 372.0 ± ± 4.0 Дж К-1 моль-1. Величина теплоемкости эпсомита Ср(298.15, MgSO4 • 7Н20) = 383.43 ± ± 0.29 Дж К-1 моль-1 находится в разумном согласии с данными [12]: СО(298.15, MgSO4 • 7Н20) =
3
Таблица 4. Теплоемкость и термодинамические функции эпсомита MgSO4 ■ 7H20(k) в области 0-303 К; ММ = = 246.469 г моль-1
T, K c0 (T) S0(T) H°(T) - H0(0) T, K Cp (T) S°(T) H0(T) - H0(0)
Дж К-1 моль-1 Дж К-1 моль-1 Дж моль-1 Дж К-1 моль-1 Дж К-1 моль-1 Дж моль-1
1 0.0012 0.00040 0.00030 90 131.85 88.38 5094.31
2 0.0097 0.0035 0.0058 95 139.22 95.70 5772.04
4 0.078 0.027 0.083 100 146.47 103.03 6486.33
6 0.26 0.089 0.40 110 160.59 117.65 8022.05
8 0.624 0.209 1.27 120 174.34 132.22 9697.1
10 1.22 0.408 3.07 130 187.75 146.71 11508
12 2.10 0.703 6.35 140 200.85 161.10 13451
14 3.32 1.114 11.73 150 213.70 175.40 15524
16 4 .92 1.659 19.93 160 226.28 189.59 17724
18 6.90 2.349 31.70 170 238.62 203.69 20049
20 9.25 3.194 47.80 180 250.75 217.66 22496
25 16.52 6 .005 111.5 190 262.67 231.54 25063
30 25.24 9.771 215.5 200 274.31 245.31 27748
35 34.78 14.37 365.3 210 285.97 258.98 30550
40 44.69 19.66 563.9 220 297.39 272.55 33467
45 54.62 25.50 812.2 230 308.69 286.02 36498
50 64.39 31.76 1189.8 240 319.92 299.40 39641
55 73.88 38.34 1455.7 250 330.94 312.68 42895
60 83.05 45.17 1848.1 260 341.96 325.87 46259
65 91.87 52.17 2285.5 270 352.89 338.98 4973
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.