ЗАЩИТА МЕТАЛЛОВ, 2008, том 44, № 3, с. 312-320
УДК 620.193:669.14
МЕТОДЫ ИЗУЧЕНИЯ ФИЗИКО-ХИМИЧЕСКИХ СИСТЕМ
ТЕРМОДИНАМИКА ХИМИЧЕСКОИ И ЭЛЕКТРОХИМИЧЕСКОИ УСТОЙЧИВОСТИ АЛЮМИНИЕВЫХ, КРЕМНИСТЫХ И ОЛОВЯННЫХ БРОНЗ
© 2008 г. А. Г. Тшрин
Челябинский государственный университет 454021 Челябинск, ул. Бр. Кашириных, 129 E-mail: tag@csu.ru Поступила в редакцию 20.12.06 г.
Построены фазовые диаграммы типа медь-элемент-кислород и потенциал-рН для сплавов систем Cu-Al, Cu-Si и Cu-Sn при 25°С. Анализируются термодинамические особенности коррозионно-электрохимического поведения фазовых составляющих алюминиевых, кремнистых и оловянных бронз. Оценивается поверхностная активность легирующих элементов.
PACS: 81.65.Kn
Различают две основных группы медных сплавов: латуни - сплавы меди с цинком, и бронзы -сплавы меди с другими элементами, в числе которых, наряду с другими, может быть и цинк [1]. По основному легирующему элементу бронзы подразделяют на оловянные, алюминиевые, кремнистые и другие. Оловянная бронза Бр010 (9-11 мас. %) -самый древний сплав [2]. Структура оловянных бронз состоит из твердого раствора олова в меди с решеткой г.ц.к. (а-фазы) и эвтектической смеси (а + Си318и8). Алюминиевые бронзы БрА7 содержат 6-8 мас. % А1. По прочности и стойкости против коррозии они превосходят оловянные бронзы. Структура алюминиевых бронз может быть однофазной (а-фаза (Си)) или двухфазной (а + у2); у2-фаза представляет собой твердый раствор с решеткой г.ц.к. на основе соединения с электронной концентрацией 21/13 [2]. В состав кремнистой
бронзы БрК1 входит 0.6-1.1 мас. % - это гомогенная а-фаза (Си) [1].
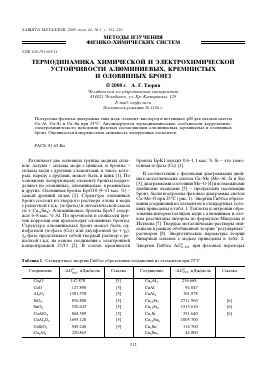
В соответствии с фазовыми диаграммами двойных металлических систем Си-Ме (Ме-А1, и Би) [3], диаграммами состояния Ме-О [4] и возможными двойными оксидами [5] - продуктами пассивации бронз, были построены фазовые диаграммы систем Си-Ме-0 при 25°С ( рис. 1). Энергии Гиббса образования соединений из элементов в стандартных условиях приведены в табл. 1. Теплоты и энтропии образования интерметаллидов меди с алюминием и оловом рассчитаны автором по формулам Миедемы и Истмена [7]. Твердые металлические растворы описывали в рамках обобщенной теории "регулярных" растворов [8]. Энергетические параметры теории бинарных сплавов с медью приведены в табл. 2.
Энергии Гиббса А 0°Г1298 при фазовых переходах
Таблица 1. Cтандартные энергии Гиббса образования соединений из элементов при 25°С
Соединение -AG<298, кДж/моль Ссылка Соединение -AG<298, кДж/моль Ссылка
CU2O 147.878 [5] Cu4Al3 236.668
CuO 127.890 [5] CuAl 94.047
AI2O3 1581.338 [5] CuAl2 101.978
SÍO2 856.800 [5] Cu33Si7 2711.960 [6]
SnO2 520.443 [5] Cu15SÍ4 1513.610 [6]
CuAlO2 868.589 [5] Cu3Si 351.640 [6]
CuAl2O4 1695.120 [5] Cu31Sn8 1005.700
CuSiO3 949.240 [5] Cu3Sn 116.700
Cu3Al2 220.863 CugS% 44.800
V - ., Др.. y = nCu + nAl
CuO
р.6
Cu2O Р.4
Cu Р.2 Cu3Al2(5)CuAl(n2)CuAl2(e)p.8 Al Cu Cu15Si4Cu3Si Р.4 Р.6 Р.8
—»-Xai (а'-фаза) (а-фаза) —"-Xsí
Рис. 1. Фазовые диаграммы систем Cu-Al-O (a) и Cu-Si-O (б) при 25°С.
Si
олова и кремния в твердый раствор на основе меди (а-фазу) составили 315 и 38071.3 Дж/моль соответственно [8].
Как следует из данных таблицы 1, химическое сродство меди к кислороду меньше, чем у легирующих компонентов бронз: алюминия, кремния, олова. При 25°С стандартное химическое сродство к кислороду возрастает в следующей последовательности: Cu —► Sn —► Si —»- Al. Поэтому равновесия с участием оксидов в системах Cu-Me-O смещены в "медный угол" (рис. 1). Так при 25°С вплоть до содержаний алюминия, кремния и олова в а-фазе (Cu) ~10-50, ~10-20 и ~ 2.0 х 10-12 мольных % единственным продуктом окисления двойных сплавов могут быть Al2O3, SiO2 и SnO2 соответственно.
Подобно сплавам Бе-Cu [9] и Бе-Zn [10], оксиды которых образуют по два устойчивых соединения, диаграмма электрохимического равновесия сплавов Cu-Al может быть реализована в двух вариантах: при концентрациях алюминия в меди выше
критической и ниже критической. Основные химические и электрохимические равновесия в системе Си-А1-Н20 при 25°С описаны в табл. 3. При концентрации алюминия в меди выше критической
Таблица 2. Энергетические параметры бинарных сплавов при 25°С
Система Фаза, Энергетические параметры, кДж/моль
тип решетки Qn q122)
Cu-Al а-фаза (Cu), -281.0 148.6
г.ц.к. у2-фаза, г.ц.к. а'-фаза (Al), -175.8 -64.7 -175.8 -64.7
Cu-Si г.ц.к. а-фаза (Cu), -381.0 -381.0
Cu-Sn г.ц.к. а-фаза (Cu), г.ц.к. -14.6 -14.6
Таблица 3. Основные химические и электрохимические равновесия в системах Си-А1-Н20, Си-81-Н20 и Си-8п-Н20 при 25°С, 1атм(воздух) и а = 1 моль/л
№ на рис. Электродная реакция Равновесный потенциал (В), или рН раствора
а 2Н+ + 2е = Н2(г); Рн2 « 5 х 10-7 атм 0.186 - 0.0591рН
Ь 02 + 4Н+ + 4е = 2Н20; Ро2 « 0.21 атм 1.219 - 0.0591рН
1. А13+ + 3е = А1(а'); аА1(а') ~ 1 -1.662[11]
2. СиА1(п2) + А13+ + 3е = СиА12(0) -1.636
3. Си4А13(^2) + А13+ + 3е = 4СиА12(п2) -1.461
4. 4Си4А12(5) + А13+ + 3е = 3Си4А13(^2) -1.420
5. Си(у2) + А1(уз) + А13+ + 3е = Си3А12(5); -1.390
«Си(у2) = 1.9 х 10-4; аА1(у2)» 1.2 х 10-14
6. А13+ + 3е = А1(а ^ у2); аА1(а) « 2.4 х 10-16 -1.383
7. Си2+ + 2е = Си(а); аСи(а) = 1 0.337
8. А1203 + 6Н+ + 6е = 2А1(а')+3Н20; аА1(о0 « 1 -1.503 - 0.0591рН
9. 2СиА1(п2) + А1203 + 6Н+ +6е = 2СиА12(0) + 3Н20 -1.475 - 0.0591рН
10. 2А13+ + Н20 = А1203 + 6Н+ рН 2.71
11. 2Си4А13(^2) + А1203 + 6Н+ + 6е = 8СиА1(п2) + 3Н20 -1.300 - 0.0591рН
12. 8Си3А12(5) + А1203 + 6Н+ + 6е = 6Си4А13(^2) + 3Н20 -1.259 - 0.0591рН
13. Си(у2) + А1(у2) + А1203 + 6Н+ + 6е = Си3А12(5) + 3Н20; -1.229 - 0.0591рН
«Си(у2) = 1.9 х 10-4; ЙА1(у2)» 1.2 х 10-14
14. А1203 + 6Н+ + 6е = 2А1(а ^ у2) + 3Н20; аА1(а) = 2.4 х 10-16 -1.212 - 0.0591рН
15. 2СиА102 + 2Н+ + 2е = А1203 + 2Си(а) + 3Н20; аСи(а) = 1 0.417 - 0.0591рН
16. СиА102 + 4Н+ + е = А13+ + Си(а) + 2Н20; аСи(а) = 1 0.900 - 0.2364рН
17. А13+ + Си2+ + 2Н20 + е = СиА102 + 4Н+ -0.226 + 0.2364рН
18. А1203 + 2Си2+ + Н20 + 2е = 2СиА102 + 2Н+ 0.257 + 0.0591рН
19. 2СиА1204 + 2Н+ + е = А1203 + СиА102 + Н20 0.853 - 0.0591рН
20. СиА1204 + 2Н+ = Си2+ + А12033 + Н20 рН 5.03
21. Си20 + 2Н+ + 2е = 2Си(а) +Н20; аСи(а) = 1 0.493 - 0.0591рН
22. 2Си0 + 2Н+ + 2е = Си20 + Н20 0.575 - 0.0591рН
23. А13+ + е + Си20 + Н20 = СиА102 + 2Н+ 0.026 + 0.1182рН
24. 2Си2+ +Н20 + 2е = Си20 + 2Н+ 0.211 + 0.0591рН
25. А13+ + Си2+ + 2Н20 = СиА102 + 4Н+ -0.226 + 0.2364рН
26. Си2+ +Н20 = Си0 + 2Н+ рН 3.08
27. Си0 + А13+ +Н20 + е = СиА102 + 2Н+ 0.138 + 0.1182рН
28. Си0 + СиА1204 + 2Н+ + 2е = 2СиА102 + Н20 0.784 - 0.0591рН
29. СиА1204 + 6Н+ =Си0 + 2А13+ +Н20 рН 3.64
30. БЮ2 + 4Н+ + 4е = + 2Н20 -0857 - 0.0591рН [11]
31. БЮ2 + Си15Б14 + 4Н+ + 4е = 5Си3Б1 + 2Н20 -0.223 - 0.0591рН
Таблица 3. Окончание
№ на рис. Электродная реакция Равновесный потенциал (В), или рН раствора
32. 9Si02 + 5Си33Б17 + 36H+ + 36e = 11Си^4 + 18H20 0.033 - 0.0591рН
33. 7Si02 + 33Си(а)+2Н+ + 28e = Cu33Si7 + 14H20; аСи(а) = 0.92 0.147 - 0.0591рН
34. 2CuSi03 + 2Н+ + 2e = Си20 + 2Si02 + Н20 0.501 - 0.0591рН
35. CuSi03 + 2Н+ = Си2+ + Si0 + Н20 рН 2.45
36. Sn2+ + 2e = Sn(p); « 1 -0.136[11]
37. Sn4+ + 2e = Sn2+ 0.15 [11]
38. 2Cu3Sn + 3Sn4+ + 12e = Си^5 0.192
39. Cu31Sn8 + 3Sn4+ + 12e = 11Cu3Sn 0.229
40. 31Cu(а)+8Sn4+ + 32e = Cu31Sn8; аСи(а) = 0.78 0.303
41. Sn02 + 4Н+ + 4e = Sn(P) + 2Н20; aSn(e) « 1 -0.117 - 0.0591рН [11]
42. Sn02 + 4Н+ +2e = Sn2+ + 2Н20 -0.098 - 0.1182рН
43. 2Cu3Sn + Sn02 + 12Н+ +12e = Cu6Sn5 + 6Н20 0.0683 - 0.0591рН
44. 3Cu31Sn8 + 7Sn02 + 28Н+ + 28e = 3^u3Sn + 14Н20 0.1052 - 0.0591рН
45. 31Си(а)+8 Sn02 + 32Н+ + 32e = Си3^8 + 16Н20 0.179 - 0.0591рН
46. Sn02 + 4Н+ = Sn4+ + 2Н20 рН - 2.10
(CA > CA) на диаграмме потенциал - рН системы (рис. 2) можно выделить 17 областей преобладания различных фаз системы: I - а-фаза(Сц) + у2-фаза +
5-фаза(Си3А12) + ^2-фаза(Си4А13) + п2-фаза(СиА1) +
6-фаза(СиА12) + а'-фаза(А1); II - а-фаза(Си) + у2-фа-за + Си3А12(5) + Си4А13(^2) + СиА1(п2) + СиА12(9) + + А13+; III - а-фаза(Си) + у2-фаза + + Си3А12(5) + + Си4А13(^2) + СиА1(п2) + А13+; IV - а-фаза(Си) + у2-фа-за + Си3А12(5) + Си4А13(У + А13+; V - а-фаза(Си) + + у2-фаза + Си3А12(5) + А13; VI - а-фаза(Си) + у2-фа-за + А13+; VII - а-фаза(Си) + А13+; VIII - А13+, Си2+; IX - а-фаза(Си) + у2-фаза + Си3А12(5) + Си3А12(^2) + + СиА1(п2) + СиА12(б) + А1203; X - а-фаза(Си) + + у2-фаза + Си3А12(5) + Си4А13(^2) + СиА1(п2) + + А1203; XI - а-фаза(Си) + у2-фаза + Си3А12(5) + + Си4А13(^2) + А1203; XII - а-фаза(Си) + у2-фаза + + Си3А12(5) + А1203; XIII - а-фаза(Си) + у2-фаза + А1203; XIV - а-фаза(Си) + + А1203; XV - СиА102; XVI - А1203 + Си2+; XVII - А1203 + СиА1204.
Область I - область термодинамической устойчивости (иммунности) всех металлических фаз системы Си-А1. Области II-VII, IX-XIV - области селективной коррозии алюминия из разных железо-алюминиевых сплавов. Область VIII - область
общей коррозии - активного растворения сплавов. Области ГХ-ХУП - области оксидной пассивизации.
При содержании алюминия в поверхностном слое сплавов до ~10-50 мол. % первичная пассиваци-онная пленка представляет собой чистый А1203. Далее в слабокислых, нейтральных и щелочных средах при анодной поляризации возможна трансформация фазового слоя окислов по схеме: А1203 —-—► СиА102 —► А1203 + СиА1204. Здесь медь может принимать участие в пассивации сплавов за счет образования алюминатов СиА102 и СиА1204. При этом область устойчивости СиА102 (область XV) значительна. При следах алюминия в а-фазе(Си) реализуется вариант диаграммы электрохимического равновесия, представленной на рис. 3. В этом случае в системе можно выделить лишь 10 областей преобладания: I - а-фаза(Си) + А13+; II - А13+, Си2+; III - Си20 + А13+; IV - СиА102 + А13+; V - а-фаза (Си) + А1203; VI - а-фаза (Си) + СиА102; VII - Си20 + + СиА102; VIII - Си0 + СиА102; IX - Си0 + А13+; X -Си0 + СиА1204.
Алюминия в данном сплаве недостаточно, чтобы образовать сплошной пассивирующий слой А1203 или СиА102, и процесс стабилизируется с учетом простых оксидов меди (Си20, Си0). Очевидно, что в этом случае коррозионно-электрохимические
ф, Б(н.в.э.)
0.6
0.5
0.4
0.3
0.2
0
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.