ЖУРНАЛ ФИЗИЧЕСКОЙ ХИМИИ, 2014, том 88, № 10, с. 1487-1493
ФИЗИЧЕСКАЯ ХИМИЯ ^^^^^^^^^^^^^^ РАСТВОРОВ
УДК 535.37 + 539.19 + 543.42.062
ЗАВИСИМОСТЬ ОСНОВНЫХ СВОЙСТВ ^о-НИТРО-ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ р-ОКТАЭТИЛПОРФИНА ОТ ПРИРОДЫ ЗАМЕСТИТЕЛЕЙ
© 2014 г. С. Г. Пуховская*, Ю. Б. Иванова**, Дао Тхе Нам*, А. С. Вашурин*
*Ивановский государственный химико-технологический университет ** Российская академия наук, Институт химии растворов им. Г.А. Крестова, Иваново
E-mail: svetlana.puhovskaya@mail.ru Поступила в редакцию 27.11.2013 г.
Методом спектрофотометрического титрования исследованы основные свойства серии порфиринов с последовательно нарастающей степенью деформации макроцикла за счет введения сильных электроно-акцепторных заместителей: 2,3,7,8,12,13,17,18-октаэтилпорфирина (I), 5-нитро-2,3,7,8,12,13,17,18-ок-таэтилпорфирина (II), 5,15-динитро-2,3,7,8,12,13,17,18-октаэтилпорфирина (III), 5,10,15-тринитро-2,3,7,8,12,13,17,18-октаэтилпорфирина (IV) и 5,10,15,20-тетранитро-2,3,7,8,12,13,17,18-октаэтилпор-
фирина (V). Установлено, что полученные значения 1ё Кь (суммарных констант основности) для изученных соединений закономерно уменьшаются с увеличением числа мезо-заместителей: 11.85 (I) > > 10.45 (II) > 10.31(Ш) > 10.23(ГУ) > 9.56 (V). Показано, что на изменение основных свойств в приведенном ряду соединений оказывают влияние два противоположно направленных фактора: структурный и электронный эффекты заместителей.
Ключевые слова: порфирины, кислотно-основные свойства, электронные эффекты заместителей, структура.
DOI: 10.7868/S004445371410032X
Кислотно-основные свойства — одни из наиболее важных физико-химических свойств порфиринов. Для сложных кислот и оснований процесс передачи протона является многостадийным и может протекать через ряд промежуточных ионных форм. Поэтому особую роль в развитии современной теории кислотно-основного взаимодействия представляют исследования специфики многоцентровых кислот и оснований таких, как порфирины (Н2Р) и их структурные аналоги [1]. Порфирины можно рассматривать как типичные амфо-терные соединения, обладающие одновременно основными (М-основания) и очень слабыми кислотными (МИ-кислоты) свойствами. В зависимости от кислотности среды можно получить как одно-, так и двухзарядные ионы, находящиеся в равновесии друг с другом и с нейтральной формой [2].
Как показано в работах [3—8], введение в мезо- и Р-положения порфиринового макроцикла большого числа заместителей может оказывать значительное влияние как на координационные, так и на кислотно-основные свойства порфиринов. С целью систематического изучения влияния степени деформации тетрапиррольного макрокольца и электронных эффектов заместителей на основные свойства в настоящей работе исследована серия порфи-
ринов с последовательно нарастающей степенью деформации макроцикла за счет введения сильных электроноакцепторных заместителей в сравнении с 2,3,7,8,12,13,17,18-октаэтилпорфирином. Ниже представлены структуры изученных соединений: 2,3,7,8,12,13,17,18-октаэтилпорфирин (I), 5-нитро-
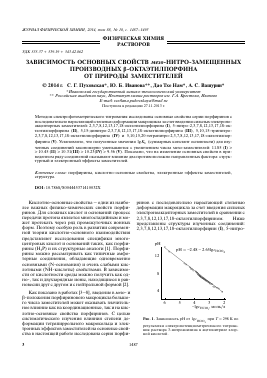
—ё сисю,-, моль/л
Рис. 1. Зависимость рИ от 1ёсисю4 при Т = 298 К по
результатам спектропотенциометрического титрования раствора 3-нитроанилина в ацетонитриле хлорной кислотой.
2,3,7,8,12,13,17,18-октаэтилпорфирин (II), 5,15-ди-нитро-2,3,7,8,12,13,17,18-октаэтилпорфирин (III), 5,10,15-тринитро-2,3,7,8,12,13,17,18-октаэтилпор-
фирин (IV) и 5,10,15,20-тетранитро-2,3,7,8,12,13,17,18-октаэтилпорфирин (V):
Et R
Et
Et R4
Et
Et R
f
Et
Et
R2 Et
I: R1 — R2 — R3 — R4 — H, II: R — R2 — R3 — H, R4 — NO2, III: R1 — R3 — H, R4 — R2 — NO2, IV: R — H, R2 — R3 — R4 — NO2, V: R — R2 — R3 — R4 — NO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные в работе порфирины II—V синтезировали по известным методикам [9, 10]. Очистку проводили хроматографически на Al2O3 (III степени активности по Брокману). В качестве элюента использовали дихлорметан. Индивидуальность соединения контролировали методом тонкослойной хроматографии на пластинах Silu-fol с толщиной слоя 0.5 мм ("Merck"), элюент: CH2Cl2.
Электронные спектры поглощения (ЭСП) порфиринов I—V регистрировали на спектрофотометрах "Shimadzu UV-1800" и "Hitachi U-2000". ИК-спектры регистрировали на спектрометре Avatar 360 FTTIR ESP в таблетках бромида калия. Спектры Н1 ЯМР записывали на спектрометре "Bruker-500" c рабочей частотой 500 МГц в CDCl3 (внутренний стандарт — ТМС).
Порфирин II: ЯМР !Н, (Ô, м. д.) CDCl3 (ТМС) 10.25 с. (1H, мезо-H); 10.08 с. (2H, мезо-H); 4.11 м (12H, -CT2CH3) и 3.76 м (4Н); 1.95 - 1.57 м (24H, -CT2CH3); -3.57 с (H, NH) и -3.79 с (H, NH); ИК-спектр в таблетках KBr, см-1: 1536 (ôas NO2), 1383 (ôs NO2).
Порфирин III: ЯМР !Н, (8, м. д.) CDCl3 (ТМС) 10.33 с. (1H, мезо-H); 4.10 м; 3.68 м, 1.94 - 1.25 м (СН2СН3); -3.38 с (H,NH). ИК-спектр в таблетках KBr, см-1: 1536 (8as NO2), 1383(8s NO2).
Порфирин IV: ЯМР !Н, (8, м. д.): 10.07 с. (1H, мезо-H); 3.97 кв и 3.57 м (16H, -Œ2CH3); 1.81 -1.44 м (24H, -CT2CH3); -3.47 с (2H, NH); ИК-спектр, см-1: 1536 (8as NO2), 1383(8s NO2).
Порфирин V: ЯМР 1Н, (8, м. д.): 3.49 (16Н., 1.43.(24Н); ИК-спектр, см-1: 1533 (8as NO2), 1370 (8s NO2).
Использованные в работе растворители (хлороформ, дихлорметан, хлорная кислота, ацетонитрил) очищали по стандартным методикам [11, 12].
Основные свойства порфиринов I-V изучали методом спектрофотометрического титрования в
системе ацетонитрил (АН) — хлорная кислота при Т = 298 К. С использованием полученных раннее данных спектропотенциометрического исследования рН-функции стеклянного электрода (ЭСЛ 43-07) в АН и температурной калибровки электродной системы ЭСЛ 43-07 — хлорсеребряный электрод (ЭВМ 1-М3, заполненный раствором Е^КС1, насыщенным при 293К) по ж-нитроани-лину (р^а = 7.6) [13—16], установлена зависимость
рН — ^ с НСЮ4 (рис. 1). Эти данные использовали
при построении кривых титрования порфиринов I—V (рис. 2—6). Методики проведения эксперимента и обработки экспериментальных данных соответствовали представленным в работах [17, 18]. Ошибка в определении констант основности с
A 2 г
500
600
700
800
X, нм
Рис. 2. Изменение ЭСП порфирина I (спорф — 1.25
х 10 4 моль/л) и кривая спектрофотометрического титрования (X = 546 нм) в системе ацетонитрил — НС104 (с НС10 = 0 - 1.4 х 10-4 моль/л) при 298 К.
х
A 1.5
500
600
700
800
X, нм
Рис. 3. Изменение ЭСП порфирина II (спорф = 5 х 10 5 моль/л) и кривая спектрофотометрического титрования (X = = 500 нм) в системе ацетонитрил — HClO4 ( c HClO = 0—1.43 х 10-4 моль/л) при 298 К.
A 3
400
500
600
700
X, нм
Fig. 4. Изменения ЭСП порфирина III (спорф = 2 х 10 4 моль/л ) и кривая спектрофотометрического титрования (X =
= 419 нм) в системе ацетонитрил — HClO4 ( cHClO = 0—5 х 10 4 моль/л ) при 298 К.
использованием индикаторного метода составляла не более 5—7%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Физико-химические исследования целого ряда стерически искаженных порфиринов показали прямую корреляцию между степенью непланарности порфиринового макроцикла и свойствами этих соединений [3, 19-24]. Как известно, по сравнению с плоскими аналогами
основность пространственно искаженных мезо-фенилзамещенных производных октаалкил-порфиринов значительно увеличена, что обусловлено уменьшением их ароматичности и обособлением п-электронных систем пирроль-ных и пирролениновых фрагментов [3, 4]. Однако введение в мезо-положения порфириново-го макроцикла сильных электроноакцепторных заместителей (—N0^ способствует снижению электронной плотности на центральных атомах азота реакционного центра из-за действия от-
2
1
0
A
0Li
300
400
500
600
700
800
X, нм
Рис. 5. Изменение ЭСП порфирина IV (спорф = 2 х 10 4 моль/л) и кривая спектрофотометрического титрования (X = = 447 нм) в системе ацетонитрил — ИСЮ4 (с нею = 0—5 х 10-4 моль/л) при 298 К.
2
300 400 500 600 700 800
X, нм
Рис. 6. Изменение ЭСП порфирина V (спорф = 2.21 х 10-5 моль/л) и кривая спектрофотометрического титрования (X : = 460 нм) в системе ацетонитрил — ИС104 (с ИС10 = 0—5.5 х 10-4 моль/л) при 298 К.
рицательного индукционного эффекта и эффекта сопряжения, что в результате приводит к понижению основности молекулы.
Процесс протонирования пирролениновых (=К—) атомов азота порфиринового макроцикла можно представить следующими уравнениями:
И2Р + Н+ ^^ И3Р+, (1)
Н3Р+ + И+ = Н4Р2+. (2)
Здесь Н2Р, H3P+, H4P2+ — соответственно нейтральная и моно- и дипротонированные формы порфиринов.
При спектрофотометрическом титровании аце-тонитрильных растворов лигандов (I—V) хлорной кислотой характерный для свободных порфиринов четырехполосный (в видимой части) ЭСП превращается в трех-, а затем и двухполосный, обычный для спектров поглощения дикатионов. Для исследованных порфиринов спектральные характеристики протонированных форм приведены в таб-
Спектральные характеристики порфиринов 1—У и их моно- и дипротонированных форм
Соедине- Растворитель ^шах, нм (^ Е) ЯМР ХН, (5, м.д.), CDC13 (Н2Р)
Соре ТС III II 1 мезо-Н М—Н
I Н2Р СНС13 400 (5.25) 499 (4.15) 535 (4.04) 568 (3.86) 620 (3.74) 600
Н3Р+ АН—НС104 397 532 (пл) 554 590 10.10с —3.75с
н4р2+ АН—НС104 398 — — 548
II Н2Р СНС13 397 (5.08) 502 (4.05) 537 (3.88) 571 (3.74) 624 (3.67)
Н3Р+ АН—НС104 397 — 532 573 625 10.25с; 10.08с —3.57с; —3.79с
Н4Р2+ АН—НС104 396 — 575 627
III Н2Р СНС13 424 (5.71) 500 (3.78) 545 (3.81) 581 (3.84) 634 (3.88)
Н3Р+ АН—НС104 419 — 538 575 620 10.33 —3.38с
н4р2+ АН—НС104 419 — 568 620
ГУ Н2Р СНС13 414 (5.07) 513 (4.05); 539 (пл) 591 (3.67); 641 (3.39)
Н3Р+ АН—НС104 439 — 539 593 644 10.07с —3.47с
Н4Р2+ АН—НС104 446 — — 591 646
У Н2Р СН2С12 426 (4.82) 530 (3.96), 572 (3.57пл) 611 (3.57) 665 (3.03) —3.32
Н3Р+ АН—НС104 459 533 599 ^Ь) 667 ^Ь)
Н4Р2+ АН—НС104 460 607 669
лице. На рис. 2—6 показаны спектральные изменения при увеличении концентрации НС104. Двухступенчатые и монотонные кривые спектрофотометрического титрования при наличии двух семейств изосбестических точек свидетельствуют о последовательном процессе протонирования с тем лишь различием, что константы равновесия процессов моно- и дипротони
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.