ЖУРНАЛ НЕОРГАНИЧЕСКОЙ ХИМИИ, 2011, том 56, № 11, с. 1908-1912
ФИЗИКО-ХИМИЧЕСКИИ АНАЛИЗ НЕОРГАНИЧЕСКИХ СИСТЕМ
УДК 541.123.3:543.572.3
ТРЕХКОМПОНЕНТНАЯ ВЗАИМНАЯ СИСТЕМА Li,K||Cl,MoO4 © 2011 г. Е. И. Малышева, И. К. Гаркушин, Т. В. Губанова, Е. И. Фролов
Государственное общеобразовательное учреждение высшего профессионального образования Самарский государственный технический университет Поступила в редакцию 15.06.2010 г.
Методом дифференциального термического анализа изучены фазовые равновесия в трехкомпонентной взаимной системе Li,K||Cl,MoO4. Определены характеристики трех тройных эвтектик: Ei — 348°С и 41 мол. % KCl, 7.75 мол. % Li2MoO4, 51.25 мол. % LiCl; Е2 - 475°С 44 мол. % KCl, 17.25 мол. % Li2MoO4, 38.75 мол. % LiCl; Е3 - 477°С и 35 мол. % KCl, 47 мол. % Li2MoO4, 18 мол. % LiCl.
В последнее время все возрастающий интерес вызывает проблема поиска эффективных низкоплавких электролитов для химических источников тока и фазопереходных теплоаккумулирующих материалов на основе многокомпонентных солевых систем, включающих соли щелочных элементов [1]. Поэтому представляет интерес система Ы,К||С1,Мо04 — для выявления не только характеристик низкоплавких составов, фазовых реакций, но и основных химических реакций, протекающих в системе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования проводили методом дифференциального термического анализа (ДТА) в стандартном исполнении [2]. Термоаналитические исследования проводили в платиновых микротиглях с использованием комбинированной Р—Р/КЪ-термопары. Холодные спаи термопар термостатировали при 0°С в сосуде Дьюара с тающим льдом. Скорость нагревания и охлаждения образцов составляла 10—15 град/мин и регулировалась терморегулятором. Масса навесок составляла
0.3 г Квалификация исходных солей: LiCl и K2MoO4— "х. ч.", Li2MoO4 и KCl — "ч. д. а."; индифферентное вещество — свежепрокаленный оксид алюминия. Все составы выражены в мол. %, температура — в °С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящей работе исследована трехкомпо-нентная взаимная система из хлоридов и молибда-тов лития и калия. В системе Li, K||Cl,MoO4 ранее были исследованы двойные системы, составы и температуры плавления квазибинарных эвтектик в стабильных секущих KCl—Li2MoO4 и KCl—Li2MoO4 • • K2MoO4 (D) [3—6] (табл. 1).
Изучение тройной взаимной системы включало следующие этапы.
1. Определение направления реакции обмена и теоретическое разбиение системы.
2. Экспериментальное исследование политермического разреза АВ (А — 30.0% KCl, 70.0% LiCl; B — 30.0% KCl, 70.0% K2MoO4), выбранного в соответствии с правилами проекционно-термографическо-
Таблица 1. Характеристики точек нонвариантного равновесия, входящих в тройную взаимную систему Ы,К||С1,Мо04
Система Характер Содержание компонентов, мол. % Температура Литература
точки первого второго третьего плавления, °C
LiCl—KCl Эвтектика 61.5 38.5 — 358 [4]
LiCl—Li2MoO4 Эвтектика 73.4 26.6 — 501 [6]
Li2MoO4—K2MoO4 Эвтектика Дистектика Эвтектика 41 50 67 59 50 33 — 551 575 521 [4]
Li2MoO4—KCl Эвтектика 38 62 — 509 [3]
KCl—Li2MoO4—K2MoO4 Эвтектика 33.4 33.3 33.3 493 [3]
KCl—K2MoO4 Эвтектика 46 54 — 622 [5]
1908
ТРЕХКОМПОНЕНТНАЯ ВЗАИМНАЯ СИСТЕМА Li,K||Cl,MoO4 e3 622 B
1909
КС1 771°
K2MoO4 926°
e2 352 s*»
n J»
A
X /
E475
3
Л
4e7 49Й
^ /Ki ^^ ~^ e4 551
509 4 D 575
' k\£2457 \
у \ e5 521
—
ЫС1 е1 501 Ы2Мо04
610° 702°
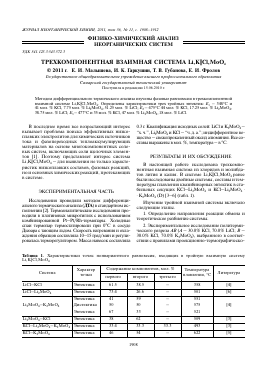
Рис. 1. Трехкомпонентная взаимная система Ы,К||С1,Мо04.
го метода (ПТГМ) [7] с целью выявления температур плавления эвтектик и перевальных точек.
3. Исследование разрезов, проходящих через проекции точек нонвариантных равновесий на разрезе АВ и хлориды лития и калия.
Одними из наиболее часто используемых критериев для определения направления реакции обмена во взаимных солевых системах являются стандарт-
ная энтальпия АН298 и энергия Гиббса Аг0298 реакции обмена. Для тройной взаимной системы Ы,К||С1,Мо04 эти величины имеют следующие числовые значения (данные для расчета взяты из [8]):
2ЫС1 + К2Мо04 ^ Ы2Мо04 + 2КС1 (точка полной конверсии К, рис. 1)
Таблица 2. Характеристики фазовых равновесий в системе Ы,К||С1,Мо04
Элемент диаграммы Характер равновесия Фазовые равновесия
Е\ Нонвариантное ж =3=* LiCl + Li2MoO4 + KCl
Е2 Нонвариантное ж D + a-K2MoO4 + KCl
Ез Нонвариантное ж D + Li2MoO4 + KCl
ехЕх Моновариантное ж Li2MoO4 + LiCl
е2Е1 Моновариантное ж « LiCl + KCl
ебЕ1 Моновариантное ж Li2MoO4 + KCl
е5Е2 Моновариантное ж D + Li2MoO4
е6Е2 Моновариантное ж ^ Li2MoO4 + KCl
е7Е2 Моновариантное ж ^ D + KCl
е3Е3 Моновариантное ж a-K2MoO4 + KCl
е4Е3 Моновариантное ж a-K2MoO4 + D
е7Е3 Моновариантное ж « D + KCl
Примечание. D — соединение Li2MoO4 • K2M0O4.
1910
МАЛЫШЕВА и др.
Рис. 2. Т—х-диаграмма разреза АВ системы Li,K||Cl,MoO4.
А ГИ(098 = —78.952 кДж/моль,
А rG{098 = —74.733 кДж/моль.
Как видно из термодинамических характеристик, равновесие смещено в сторону пары солей Li2MoO4—KCl, являющейся стабильной диагональю.
Кроме приведенной выше реакции обмена в системе протекает реакция
2LiCl + 2KMoO4 ^ Li2MoO4 + 2KCl (точка K1, рис. 1).
Стабильными секущими элементами тройной взаимной системы Li,K||Cl,MoO4 являются KCl—Li2MoO4 и KCl—D. Квадрат состава системы включает три симплекса: LiCl—Li2MoO4—KCl, Li2MoO4—D—KCl и D—KCl—K2MoO4 (рис. 1). Двойные системы, ограничивающие квадрат составов, были изучены ранее [6—8].
Для определения характеристик эвтектик в тройной взаимной системе выбран политермический разрез АВ, проходящий через три симплекса системы Li,K||Cl,MoO4. Т—х-диаграмма разреза АВ приведена на рис. 2. Ликвидус Т—х-диаграммы разреза АВ представлен четырьмя ветвями первичной кристаллизации: Аа — хлорида лития, аЬ — молибдата лития,
ТРЕХКОМПОНЕНТНАЯ ВЗАИМНАЯ СИСТЕМА Li,K||Cl,MoO,
1911
t, °C
KCl, мол. % Рис. 3. Т-х-диаграмма разреза KCl—E2—E2.
bc - хлорида калия и cB - а-молибдата калия, которые пересекают линии моновариантных равновесий е1Е1, Е1е6, е3Е3 соответственно в точках a, b и c.
Направлениям на тройные эвтектики соответствуют на Т-х-диаграмме разреза АВ точки E1, El, E2 и E3, которым после первичной кристаллизации компонента (LiCl, KCl) соответствует совместная кристаллизация трех фаз: LiCl + KCl + Li2MoO4, KCl + Li2MoO4 + D и KCl + D + a-K2MoO4.
Исследованием политермических разрезов KCl— E 2 —Е2 (рис. 3), KCl — E3 —Е3 (рис. 4) найдены состав (мол. %) и температура, отвечающие тройным эв-
t, °C
KCl, мол. % Рис. 4. Т-х-диаграмма разреза KCl—E3—E3.
тектикам Е2 и Е3: Е2 - 475°С и 44% KCl + 17.25% Li2MoO4 + 38.75% LiCl; Е3 - 457°С и 35% KCl + 47% Li2MoO4 + 18% LiCl. Состав эвтектики Е1 348°С
определен пересечением разрезов LiCl- El и Li2MoO4-E1, соединяющих полюса первично кристаллизующихся LiCl и Li2MoO4 с проекциями El и E1 соответственно эвтектики Е1 на разрез АВ (рис. 1, 2). Состав точки Е1 - 348°С и 41% KCl + 7.75% Li2MoO4 + + 51.25% LiCl подтвержден также исследованием
разреза LiCl-E"-El (рис. 5).
1912
МАЛЫШЕВА и др.
t, °C
LiCl, мол. %
Рис. 5. Т—х-диаграмма разреза LiCl—E^E^
Характеристики моно- и нонвариантных фазовых равновесий приведены в табл. 2.
Поверхность тройной взаимной системы состоит из четырех полей кристаллизации исходных компонентов: LiCl, Li2MoO4, a-^MoO4, KCl, а также двойного соединения D, сходящихся в трех эвтектических точках Е1, Е2 и Е3. Анализ термодинамического расчета направления реакций обмена и экспериментальные данные по диаграмме плавкости тройной взаимной системы Li,K||Cl,MoO4 показа-
ли, что данная система относится к типу необратимо-взаимных систем [9]. Минимальная температура эвтектики E1 — 348°С — расположена в симплексе KCl—LiCl—Li2MoO4, который включает компонент (LiCl) и двойную эвтектику (LiCl—KCl) с минимальными температурами плавления (610 и 352°С соответственно).
Выявленный низкоплавкий состав можно использовать в качестве расплавляемого электролита в химических источниках тока.
Статья написана в рамках реализации ФЦП "Научные и научно-педагогические кадры инновационной России" на 2009—2013 годы.
СПИСОК ЛИТЕРАТУРЫ
1. Делимарский Ю.К., Барчук Л.П. Прикладная химия ионных расплавов. Киев: Наук. думка, 1988. 192 с.
2. Егунов В.П. Введение в термический анализ. Самара, 1996. 270 с.
3. Анипченко Б.В. Дис. ... канд. хим. наук. Самара: Самарский гос. техн. ун-т, 1999. 98 с.
4. Диаграммы плавкости солевых систем. Ч. II / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Металлургия, 1977. 204 с.
5. Диаграммы плавкости солевых систем. Ч. III / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Металлургия, 1977. 204 с.
6. Гаркушин И.К., Губанова Т.В., Петров А.С., Анипченко Б.В. Фазовые равновесия в системах с участием метаванадатов некоторых щелочных металлов. М.: Машиностроение-1, 2005. 118 с.
7. Трунин А.С., Космынин А.С. Деп. в ВИНИТИ 12.04.07 № 1372-77.
8. Гаркушин И.К., Замалдинова Г.И., Никитина Н.А. Водород, щелочные металлы и их соединения. Уч. пособие. Самара: СамГТУ, 2005. 46 с.
9. Бухвалова Г.А. и др. // Журн. неорган. химии. 1973. Т. 18. № 4. С. 1106.
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.