НЕОРГАНИЧЕСКИЕ МАТЕРИАЛЫ, 2014, том 50, № 5, с. 522-524
УДК 536.63
ВЫСОКОТЕМПЕРАТУРНАЯ ТЕПЛОЕМКОСТЬ Sc2Cu2O5 © 2014 г. Л. Т. Денисова*, Ю. Ф. Каргин**, Л. Г. Чумилина*, В. М. Денисов*, С. Д. Кирик*
*Институт цветных металлов и материаловедения Сибирского федерального университета, Красноярск **Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук, Москва e-mail: antluba@mail.ru Поступила в редакцию 31.10.2013 г.
Методом дифференциальной сканирующей калориметрии определена молярная теплоемкость Sc2Cu2O5 в интервале температур 350—893 К. По экспериментальным данным Cp = f(T) рассчитаны термодинамические функции оксидного соединения.
DOI: 10.7868/S0002337X14050042
ВВЕДЕНИЕ
В системах CuO-R2O3 (R = Tb - Lu, Y, Sc) образуются соединения R2Cu2O5 [1, 2]. Из них наименее изученным является Sc2Cu2O5, для которого имеются сведения о кристаллической структуре [3, 4], магнитных свойствах [4-6], ИК- и рамановских спектрах [7]. В то же время данные о теплофизических свойствах при высоких температурах отсутствуют. Очевидно, что замена одного редкоземельного элемента в купратах на другой может влиять на их свойства. Поскольку фазовые отношения в системе CuO-Sc2O3 не изучены и диаграмма состояния (являющаяся основой экспериментального подбора условий синтеза) не построена, представляется целесообразным исследовать термодинамические свойства Sc2Cu2O5, так как методы термодинамики позволяют определить условия синтеза соединений. Кроме того, теплоемкость является термодинамической характеристикой вещества [8, 9].
Целью настоящей работы является исследование высокотемпературной теплоемкости и определение термодинамических свойств Sc2Cu2O5.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Измерение молярной теплоемкости Sc2Cu2O5 проведено методом дифференциальной сканирующей калориметрии (ДСК) на приборе STA 449C Jupiter (NETZSCH) в интервале температур 350983 К. При этом использовали специальные держатели для измерения теплоемкости. Все опыты проведены в платиновых тиглях. Методика экспериментов подробно описана ранее [10-12].
Образцы для измерений получены методом твердофазного синтеза. Исходные оксиды Sc2O3 и CuO ("ос.ч.") предварительно прокаливали на воздухе при 1170 К. Стехиометрическую смесь перетирали в агатовой ступке с последующим
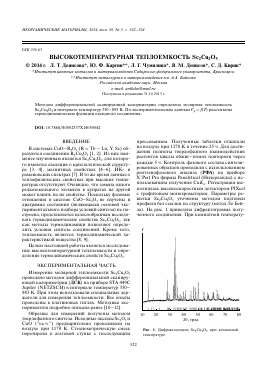
прессованием. Полученные таблетки отжигали на воздухе при 1270 К в течение 25 ч. Для достижения полноты твердофазного взаимодействия реагентов циклы обжиг—помол повторяли через каждые 5 ч. Контроль фазового состава синтезированных образцов проводили с использованием рентгенофазового анализа (РФА) на приборе X'Pert Pro фирмы Panalytical (Нидерланды) с использованием излучения Cu^a. Регистрация выполнялась высокоскоростным детектором PIXcel с графитовым монохроматором. Параметры решетки Sc2Cu2O5 уточнены методом подгонки профиля без ссылки на структуру (метод Ле Бей-ла). На рис. 1 приведена дифрактограмма полученного соединения. При комнатной температу-
29, град
Рис. 1. Дифрактограмма SC2CU2O5 при комнатной температуре.
10
20
30
40
50
60
70
80
ВЫСОКОТЕМПЕРАТУРНАЯ ТЕПЛОЕМКОСТЬ Sc2Cu2O5
523
ре образцы имели орторомбическую кристаллическую структуру (пр. гр. РпЬ21).
Сравнение полученных нами параметров элементарной ячейки 8е2Си205 с результатами других авторов показано в табл. 1. Можно заключить, что в целом имеется согласие с литературными данными.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты калориметрических измерений (рис. 2) показывают, что в исследованном интервале температур, который выбран на основе ДТА, значения молярной теплоемкости Ср закономерно увеличиваются, а на зависимости Ср = /(7) экстремумов не наблюдается. Полученная зависимость теплоемкости 8е2Си205 от температуры может быть описана классическим уравнением Майера— Келли
Cp = 190.i
: + 49.5 х 10-3T -13.15 х 105TЛ
Ср, Дж/(моль К) 240
230
220
210
200
190
400
600
800
1000
T, K
(1)
Обработку экспериментальных результатов вели с использованием лицензионной программы Sys-tat Sigma Plot 12. Коэффициент корреляции для уравнения (1) равен r = 0.9991. Максимальное отклонение экспериментальных точек от аппроксимирующей кривой в интервале температур 350— 770 К не превышает 0.2%, а при Т > 770 К - 0.5%.
Наличие температурной зависимости теплоемкости (1) позволяет по известным термодинамическим уравнениям определить изменение энтальпии H (T)—H0(350 К) и энтропии S)(T)-S)(350 К). Результаты расчетов приведены в табл. 2.
Можно отметить, что при температурах выше 700 К теплоемкость превышает предел Дюлонга— Пти 3Rs, где R — универсальная газовая постоянная, s — число атомов в формульной единице Sc2Cu2O5 (s = 9).
Считая в первом приближении, что Cp и CV для Sc2Cu2O5 близки, а также используя найденное нами значение характеристической температуры Дебая &D = 560 К (определено по экспериментальным значениям теплоемкости для минимальных температур эксперимента) и таблицы функций Дебая (&D/T) [13], мы рассчитали Cp. Полученные данные показывают, что имеется разница между экспериментальными и рассчитанными значениями Cp. Причем с ростом температуры это различие увеличивается (рис. 2). Это можно объяснить тем, что значения 0D, найденные для одного и того же вещества из экспериментальных данных при различных температурах, часто оказываются различными [13]. То есть 0D является функцией температуры.
Для описания температурной зависимости теплоемкости Cp = f(T) часто используют комбинацию функций Дебая и Эйнштейна E (0E/T) [13]
(2)
Рис. 2. Температурная зависимость теплоемкости 8с2Си205: 1 — экспериментальные данные (точки), и аппроксимирующая кривая (сплошная линия); 2 — расчет по модели Дебая.
Для Sc2Cu2O5 уравнение (2) имеет следующий вид:
Cp = D (560/T) + 0.6E (5340/ T).
(3)
Установлено, что уравнение (3) хорошо описывает зависимость Ср = /(7) для 8е2Си205 (максимальное отклонение экспериментальных данных не превышает 1%).
Сравнить полученные нами значения Cp с другими результатами не представлялось возможным, так как такие сведения отсутствуют. Тем не менее это можно сделать в первом приближении на основании данных для У2Си205. При этом примем во внимание следующее. Скандий является легким аналогом иттрия, у 8е и У /-электроны отсутствуют. Оксиды 8е203 и У203 взаимодействуют с Си0 с образованием изоструктурных соединений 8е2Си205 и У2Си205 [3—6]. Кроме того, имеются сведения о теплоемкости У2Си205. Так, авторы работы [14] приводят значение Ср(298.15 К) = 186.6 ± 0.4 Дж/(моль К), в то же время в монографии [15] при той же температуре Ср = 195.78 Дж/(моль К). Расчет по уравнению (1) для 8е2Си205 дает значение Ср(298 К) = = 190.8 Дж/(моль К). Из этих данных следует, что
Таблица 1. Параметры кристаллической решетки Sc2Cu2O5
Cp = D (0 dT ) + mE (0 eT ).
a, А b, А c, А Источник
12.017(1) 10.424(1) 3.217(1) [3]
12.036 10.434 3.219 [4]
12.0210(2) 10.4287(2) 3.217(1) Наши данные
1
НЕОРГАНИЧЕСКИЕ МАТЕРИАЛЫ том 50 № 5 2014
524
ДЕНИСОВА и др.
Таблица 2. Термодинамические функции Sc2Cu2O5
T, K Дж/(моль К) H°(T) - H°(350 К), кДж/моль S°(T) - S°(350 К), Дж/(моль К)
350 197.5 - -
400 202.5 10.00 26.71
450 206.6 20.23 51.80
500 210.4 30.66 72.77
550 213.8 41.26 92.98
600 216.9 52.03 111.7
650 219.9 62.95 129.2
700 222.8 74.02 145.6
750 225.7 85.23 161.1
800 228.4 96.59 175.7
850 231.1 108.1 189.7
900 233.8 119.7 202.9
950 236.4 131.5 215.7
для Sc2Cu2O5 и Y2Cu2O5 получены близкие значения Cp(298 К).
Работа выполнена при частичной финансовой поддержке Министерством образования и науки Российской Федерации.
СПИСОК ЛИТЕРАТУРЫ
1. Арсеньев П.А., Ковба Л.М., Багдасаров Х.С.и др. Соединения редкоземельных элементов. Системы с оксидами элементов I-III групп. М.: Наука, 1983. 280 с.
2. Freund H.-R., Müller-Buschraum Hk. Zur Kenntnis von In2Cu2O5 // Z. Anorg. Allg. Chem. 1978. V. 441. P. 103-106.
3. Murasik A., Fischer P., Troc R. et al. Study of Spin Configurations in Sc2Cu2O5 by Means of Powder Neutron
Diffraction // J. Magn. Magn. Mater. 1993. V 127. P. 365-372.
4. Troc R., Klamut J., Bukowski Z. et al. On the Magnetic Ordering in the R2Cu2O5 Systems // Phys. B. 1989. V. 154. P. 189-196.
5. Kazei Z.A., Kolmakova N.P., Levitin R.Z. et al. Meta-magnetism of Cuprates R2Cu2O5 // J. Magn. Magn. Mater. 1990. V. 86. P. 124-134.
6. Janiki J., Troc R. Quasi-One-Dimensional Magnetic Properties of the (In; Sc; Lu; Y)2Cu2O5 Oxides // J. Phys. Condens. Matter. 1992. V. 4. P. 6267-6274.
7. Hanuza J., AndruszkiewiczM., Bukowski Z. et al. Vibra-tional Spectra and Phonon Calculations for the M2Cu2O5 Binary Oxides (M = In, Sc, Y or from Tb to Lu) // Spectrochim. Acta. 1990. V. 46A. № 5. P. 691.
8. ГавричевК.С., Рюмин М.А., Тюрин А.В. и др. Уточнение теплоемкости и термодинамических функций GdVO4 // Неорган. материалы. 2011. Т. 47. № 10. С. 1231-1236.
9. Сон Э.Е. Современное исследование теплофизиче-ских свойств веществ (на основе последних публикаций в ТВТ) // ТВТ. 2013. Т. 51. № 3. С. 392-411.
10. Денисов В.М., Иртюго Л.А., Денисова Л.Т. и др. Тепло-физические свойства монокристаллов Bi12GeO20 // ТВТ. 2010. Т. 48. № 5. С. 790.
11. Денисов В.М, Денисова Л.Т., Иртюго Л.А. и др. Тепло-физические свойства монокристаллов Bi4Ge3O12 // ФТТ. 2010. Т. 52. № 7. С. 1274.
12. Денисов В.М., Иртюго Л.А., Денисова Л.Т. и др. Теплоемкость и термодинамические свойства GaFeO3 в области 330-900 К // Неорган. материалы. 2013. Т. 49. № 12. С. 1333-1335.
13. Скуратов С.М., Колесов В.П., Воробьев В.Ф. Термохимия. М.: Изд-во МГУ, 1966. Ч. II. 434 с.
14. Гавричев К.С., Горбунов В.Е., Голушина Л.Н. и др. Теплоемкость Y2Cu2O5 в области низких температур (5-335 К) // Журн. неорган. химии. 1992. Т. 37. № 7. С. 1583-1587.
15. Моисеев Г.К., Ватолин Н.А., Маршук Л.А. и др. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ. Екатеринбург: УрО РАН, 1977. 230 с.
НЕОРГАНИЧЕСКИЕ МАТЕРИАЛЫ том 50 № 5
2014
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.