НЕФТЕХИМИЯ, 2004, том 44, № 1, с. 52-56
УДК 547.71.07
ЗАКОНОМЕРНОСТИ ГИДРОПЕРОКСИДНОГО ЭПОКСИДИРОВАНИЯ ЭТИЛАЛЛИЛЭТИЛАКРИЛАТА В ПРИСУТСТВИИ БОРИДА МОЛИБДЕНА
© 2004 г. Ю. Б. Трач, О. И. Макота
Национальный университет "Львовская политехника", Львов, Украина Поступила в редакцию 19.09.2003 г. Принята в печать 08.10.2003 г.
Исследованы закономерности эпоксидирования эталаллилэтилакрилата гидропероксидом трет-бутила в присутствии борида молибдена МоВ2. Изучено влияние концентраций исходных веществ, продуктов реакции, бутанола-1, изобутанола и воды на процесс. Предложена кинетическая схема и рассчитаны кинетические параметры процесса.
Эпоксидирование ненасыщенных соединений -важная реакция органического синтеза. Получаемые в этой реакции эпоксиды, являются исходными веществами для большого ряда продуктов [1-3], поэтому важным является исследование закономерностей процесса эпоксидирования в присутствии катализаторов, что позволяет проводить процесс с высокой селективностью по целевому продукту.
В работе [4] были изучены закономерности процесса эпоксидирования октена-1 гидропероксидом трет-бутила в присутствии катализатора МоВ2. Исследования показали, что в этом процессе при увеличении концентрации олефина более 2.5 моль/л скорость реакции перестает зависеть от его содержания в реакционной смеси, а порядок реакции по гидропероксиду и катализатору равен единице. Один из продуктов реакции -эпоксид - уменьшает скорость процесса. Влияние другого продукта - трет-бутанола более сложное. При малых концентрациях он увеличивает скорость реакции, а при больших является ингибитором процесса.
Цель настоящей работы - установить, будут ли изменяться обнаруженные закономерности в случае эпоксидирования ненасыщенного соединения другого строения - этилаллилэтилакрила-та (ЭАЭА) (соединения, содержащего карбоксильную группу и две двойные связи) гидропероксидом трет-бутила (ГПТБ) в присутствии борида молибдена МоВ2 (Кт), а также изучить влияние на процесс воды и изомеров продукта эпоксидирования - трет-бутанола (ТБС): бутанола-1 (БС) и 2-метилпропанола-1 (ИБС).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Этилаллилэтилакрилат получали по реакции Тищенко из а-этилакролеина в присутствии изо-пропилата алюминия в качестве катализатора.
Полученный этилаллилэтилакрилат очищали перегонкой и использовали продукт с содержанием основного вещества не менее 99.5%. Чистоту продукта контролировали хроматографически.
Методики получения и очистки остальных реагентов, проведения эксперимента и обработки кинетических кривых описаны в [4].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
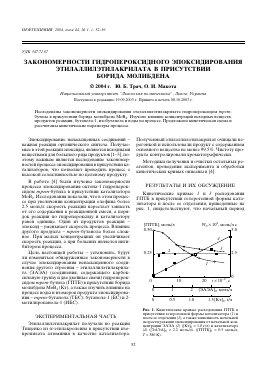
Кинетические кривые 1 и 3 расходования ГПТБ в присутствии гетерогенной формы катализатора и после ее отделения, приведенные на рис. 1, свидетельствуют, что начальный период
[ГПТБ], моль/л ^0 х 104, моль/л с
0 1 2 [ЭАЭА]0, моль/л
I_I_I_I_I
0 0.5 1.0 1.5 [Кт]0, г/л
Рис. 1. Кинетические кривые расходования ГПТБ в присутствии гетерогенной формы катализатора (1) и после ее отделения (3), а также зависимость начальной скорости реакции эпоксидирования от начальной концентрации ЭАЭА (2) ([Кт]0 = 1.0 г/л) и катализатора (4) ([ЭАЭА]0 = 2.2 моль/л). ([ГПТБ]0 = 0.5 моль/л, Т = 380 К).
х 104, моль/л с
0.50 г
0.25
х 104, моль/л с
8
0 0.5 1.0
[ГПТБ]0, [Н20]0, [ЭП]0, моль/л
Рис. 2. Зависимости начальной скорости реакции эпоксидирования от начальных концентраций эпок-сида (1) ([ГПТБ]0 = 0.5 моль/л, [Кт]0 = 1.0 г/л), воды (2) ([ГПТБ]0 = 0.5 моль/л, [Кт]0 = 1.2 г/л) и ГПТБ (3) ([Кт]0 = 1.0 г/л). ([ЭАЭА]0 = 2.2 моль/л, Т = 380 К).
ускорения процесса, как и в случае октена-1 [4], связан, по-видимому, с модификацией поверхности катализатора [5, 6].
Зависимость начальной скорости процесса эпоксидирования (^0), определенной путем экстраполяции кинетической кривой расходования гидропероксида на активированном катализаторе к начальной концентрации ГПТБ [4], от начальных концентраций ЭАЭА, ГПТБ, катализатора, 2,3-эпокси-2-этилпропилэтилакрилата (эпоксид) и воды приведено на рис. 1 и 2. Видно, что в области содержания катализатора 0-2 г/л зависимость от [Кт]0 линейная. Это указывает на первый порядок реакции по катализатору.
Изменение начальной скорости реакции W0 с ростом начальной концентрации гидропероксида ([ГПТБ]0) имеет другой вид: начальная скорость нелинейно увеличивается при увеличении [ГПТБ]0.
Зависимость W0 от начальной концентрации ЭАЭА представлена на рис. 1, кривая 3. Видно, что по сравнению с октеном-1, независимость скорости от содержания ЭАЭА проявляется при более низкой концентрации ненасыщенного соединения, что может указывать на большую устойчивость комплекса катализатор-олефин в случае ЭАЭА.
Введение воды и эпоксида (ЭП) в реакционную систему перед началом реакции приводит к уменьшению начальной скорости (рис. 2), что свидетельствует об ингибирующей роли этих веществ в реакции. Линейная зависимость между W0 и начальными концентрациями воды и эпоксида полу-
1
1
чена в координатах — от [ЭП]0 и — от [Н20]0.
Wl
W0
1.0 1.5 2.0
[ИБС]0, [БС]0, [ТБС]0, моль/л
Рис. 3. Зависимости начальной скорости реакции эпоксидирования от начальных концентраций ИБС (1) ([Кт]0 = 1.3 г/л), БС (2) ([Кт]0 = 1.3 г/л) и ТБС (3) ([Кт]0 = = 1.5 г/л).
([ЭАЭА]0 = 2.2 моль/л, [ГПТБ]0 = 0.5 моль/л, Т = 380 К).
Исследование влияния на этот процесс другого продукта - трет-бутанола (ТБС) показало, что, в зависимости от концентрации введенного в реакционную систему спирта, его влияние различно (рис. 3). При увеличении концентрации до 1 моль/л ТБС оказывает ускоряющее действие на процесс. Дальнейшее увеличение его содержания в реакционной смеси приводит к уменьшению скорости реакции.
Для выяснения, распространяются ли полученные закономерности на спирты иного строения, было изучено влияние на процесс изомеров трет-бутанола: бутанола-1 (БС) и 2-метилпропанола-1 (ИБС). Из рис. 3 видно, что область концентраций, в которой спирт ускоряет процесс, и степень этого ускорения зависят от строения спирта. Наиболее сильно, в рассчете на одинаковое количество введенного спирта, начальная скорость увеличивается в присутствии БС, ускоряющее действие которого проявляется до концентрации 0.3 моль/л. Ускоряющее действие ТБС проявляется до большего содержания спирта, однако, по сравнению с БС, скорость увеличивается медленнее. Наиболее слабое влияние на процесс оказывает ИБС.
Учитывая полученные экспериментальные данные для описания процесса можно принять общую схему реакции, предложенную для октена-1 в работе [4], дополненную с учетом влияния воды, БС и ИБС на процесс, а также уравнениями образования комплекса ЭАЭА-катализатор-ГПТБ и его превращения в продукты реакции [7]:
4
0
в начале реакции образуется комплекс ЭАЭА-ка-тализатор (Х1):
ЭАЭА + Кт
:Х1.
_ _
Х1 + ТБС ^ Х2; Х1 + ГПТБ
X,.
Х1 + ЭП ^ Х5; Х1 + Н20
Хб
В результате взаимодействия комплекса Х1 с ТБС и ГПТБ образуются каталитически активные комплексы ЭАЭА-Кт-ТБС (Х2) и ЭАЭА-Кт-ГПТБ (Х3):
Уменьшение скорости процесса после прибавления более 1 моль/л ТБС указывает на возможность образования в системе неактивного комплекса ЭАЭА-Кт-2ТБС (Х4) вследствие присоединения еще одной молекулы спирта к комплексу Х2:
„ к4 Х2 + ТБС ^ Х4.
Ингибирующее действие эпоксида и воды на процесс связано, по-видимому, с образованием неактивных комплексов ЭАЭА-Кт-ЭП (Х5) и ЭАЭА-Кт-Н20 (Х6):
БС и ИБС, как и ТБС, образуют каталитически активные комплексы ЭАЭА-Кт-БС (Х7), ЭА-ЭА-Кт-ИБС (Х9) и неактивные - ЭАЭА-Кт-2БС (Х8), ЭАЭА-Кт-2ИБС (Х10):
Х1 + БС
Х7; Х7 + БС
Х8;
Х1 + ИБС ^ Х9; Х9 + ИБС ^ Х10.
Образование эпоксида осуществляется по реакциям:
Х2 + ГПТБ
Х3 + ГПТБ
Х7 + ГПТБ
продукты; продукты;
продукты;
Х9 + ГПТБ " продукты.
Согласно данной схеме скорость расходования гидропероксида должна описываться уравнением:
W =
(кэ1 К2 [ ТБС ] + кэ2К3[ ГТПБ ] + кэ3 К7 [ БС ] + кэ4К9[ ИБС ]) К1 [ ЭАЭА ][ ГТПБ ][ Кт ]0
(1)
где Б = 1 + К1[ЭАЭА](1 + К2[ТБС] + К3[ГПТБ] + + К5[ЭП] + К6[Н20] + К7[БС] + К9[ИБС] + + К2К4[ТБС]2 + К7К8[БС]2 + К9К10[ИБС]2); К1, К2, К3, К4, К5, К6, К7, К8, К9 и К10 - константы равновесия образования комплексов Х1, Х2, Х3, Х4, Х5, Х6, Х7, Х8, Х9 и Х10 соответственно.
Зависимость начальной скорости от начальной концентрации ЭАЭА указывает, что слагаемое знаменателя: К1[ЭАЭА](1 + К2[ТБС] + К3[ГПТБ] +
+ К5[ЭП] + К6[Н20] + К7[БС] + К9[ИБС] + + К2К4[ТБС]2 + К7К8[БС]2 + К9К10[ИБС]2) по-видимому, значительно больше единицы. В этом случае порядок реакции по олефину будет равен нулю. Анализ зависимости от концентрации введенного спирта (рис. 3) позволяет также допустить, что К2[ТБС] < К2К4[ТБС]2, К7[БС] < К7К8[БС]2 и К9[ИБС] < К9К10[ИБС]2. С учетом принятых допущений уравнение (1) будет иметь вид:
W =
( к3 1 К2 [ТБС ] + кэ2 К3 [ ГТПБ ] + кЭ3 К7[ БС ] + кэА К [ ИБС ] )[ ГТПБ ][ Кт ]р 1 + К3 [ ГТПБ ] + К5[ ЭП ] + К6 [ Н20 ] + К2К4 [ ТБС ]2 + К7К8 [ БС ]2 + К9К10[ ИБС ]2
(2)
К
6
К
К
К
7
К
3
к
э1
к
э2
к
э3
к
Согласно данному уравнению порядок реакции по гидропероксиду, в зависимости от величины константы равновесия К3 может иметь значения в пределах от 1, если К3[ГПТБ] > 1, до 2, если К3[ГПТБ] < 1. Найденное экспериментально значение порядка реакции по гидропероксиду, равное 1.3, свидетельствует, что К3[ГПТБ] ~ 1. В этом случае зависимость от [ГПТБ]0 согласно уравнению (2) должна спрямляться в координатах
[ ГТПБ ]0 W 0
от [ГПТБ]0, что подтверждается экспе-
риментально и позволяет определить эффектив-
ную константу скорости эпоксидирования кэ2 и константу равновесия К3.
Уравнение (2) для зависимости начальной скорости эпоксидирования от количества введенного спирта, например ТБС, имеет вид:
W 0 =
= (клК2[ ТБС]0 + кэ2 Кз [ ГТПБ ] 0)[ГТПБ^[Кт]0. 1 + К3 [ ГТПБ ]0 + К2К4[ ТБС ] 0
Спрямление этого уравнения в координатах:
(1 + К3 [ ГТПБ ] о) W о - к э2 Кз [ ГТПБ ] 2[ Кт ] о [ ТБС ]о от W о [ ТБС ]о
позволяет рассчитать эффективную константу скорости эпоксидирования при участии спирта (в данном случае ТБС) кэ1К2 и произведение констант равновесия К2К4.
Величины констант К5 и К6 найдены с линейных зависимостей 1^0 от [ЭП]0 и 1^0 от [Н20]0.
Значения определ
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.