КИНЕТИКА И КАТАЛИЗ, 2008, том 49, № 5, с. 646-650
УДК 541.127-13:541.124.7:539.186+541.126
МЕХАНИЗМ САМОВОСПЛАМЕНЕНИЯ CS2 С 02 И ХАРАКТЕРИСТИКИ АКТИВИРОВАННОГО КОМПЛЕКСА ЛИМИТИРУЮЩЕЙ СТАДИИ
© 2008 г. В. В. Азатян, А. Ф. Шестаков*
Институт структурной макрокинетики и проблем материаловедения РАН, Черноголовка *Институт проблем химической физики РАН, Черноголовка E-mail: azatyan@ism.ac.ru Поступила в редакцию 08.11.2007 г.
На основании экспериментальных данных показано, что элементарная реакция O + CS2 = OCS + S является необходимой стадией процесса самовоспламенения сероуглерода с кислородом при невысоких температурах. Путем квантово-химического анализа определены структурные и энергетические характеристики активированного комплекса этой реакции.
Сероуглерод в воздухе самовоспламеняется даже при температурах, близких к комнатной (например, [1]), и в условиях практического отсутствия саморазогрева. Это указывает не только на разветвленно-цепной характер процесса, но также на то, что энергия активации всех стадий развития цепи, в том числе реакции размножения свободных валентностей, не превышает 7 ккал/моль. Механизмы такого типа процессов изучены крайне мало. Это тем более относится к бирадикальным цепным реакциям, каковой является горение сероуглерода. Очень мало сведений также о характеристиках активированных комплексов элементарных реакций бирадикалов, характеризующихся невысокими энергетическими барьерами.
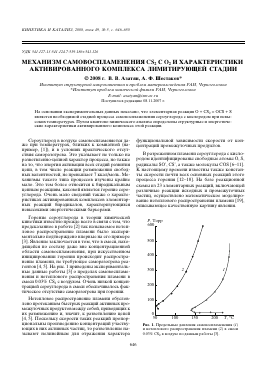
Горение сероуглерода в теории химической кинетики известно прежде всего в связи с тем, что предсказанное в работе [2] так называемое нетепловое распространение пламени было экспериментально подтверждено впервые на его примере [3]. Явление заключается в том, что в смеси, находящейся по составу даже вне концентрационной области самовоспламенения, при искусственном инициировании горения происходит распространение пламени, не требующее саморазогрева реагентов [4, 5]. На рис. 1 приведены экспериментальные данные работы [3] о пределах самовоспламенения и нетеплового распространения пламени в смеси 0.03% СБ2 с воздухом. Очень низкой концентрацией сероуглерода в смеси обеспечивалось фактическое отсутствие саморазогрева при горении.
Нетепловое распространение пламени обусловлено протеканием быстрых реакций активных промежуточных продуктов между собой, приводящих к их размножению и, значит, к разветвлению цепей [4, 5]. Поскольку скорости таких реакций пропорциональны произведению концентраций участвующих в них активных частиц, то разветвление называют нелинейным для отражения характера
функциональной зависимости скорости от концентраций промежуточных продуктов.
В разреженном пламени сероуглерода с кислородом идентифицированы свободные атомы O, S, радикалы SO\ CS\ а также молекулы COS [6-11]. К настоящему времени известны также константы скорости почти всех основных реакций этого процесса горения [12-18]. На базе реакционной схемы из 23 элементарных реакций, включающей различные реакции исходных и промежуточных частиц, осуществлено математическое моделирование нетеплового распространения пламени [19], описывающее качественную картину явления.
Рис. 1. Предельные давления самовоспламенения (1) и нетеплового распространения пламени (2) в смеси 0.03% С82 в воздухе по данным работы [3].
Однако механизм самовоспламенения смесей СБ2 с кислородом до недавнего времени не рассматривался. Также не рассматривались критические условия самовоспламенения [20-22]. Между тем режимы нетеплового распространения пламени и самовоспламенения различаются между собой не только кинетическими и макрокинети-ческими закономерностями, но также характером реакций, определяющих эти два режима.
Особенности механизма самовоспламенения С82
В отличие от нетеплового распространения пламени, для реализации которого необходимо участие двух активных частиц в реакции их размножения, для самовоспламенения необходимо, чтобы к размножению активных частиц приводила реакция лишь одной активной частицы с исходным реагентом. Поскольку скорости таких реакций зависят от концентраций активных промежуточных продуктов линейно, то принято называть их линейными стадиями. Такого типа реакцией в данной реакционной системе является стадия
О + СБ, = БО- + СБ\
(I)
Однако эта реакция не является тем разветвлением цепей, которое обуславливает самовоспламенение СБ2 при столь невысоких температурах. Действительно, образующийся радикал СБ-не способен при температурах ниже 500 К продолжать реакционную цепь, поскольку энергия активации реакции
СБ- + О2 = ОСБ + О (II)
превышает 15 ккал/моль [14], и константа скорости, например, при 340 К в смеси, содержащей 2030% СБ2, равна лишь 2 х 106 см3 моль-1 с-1. Соответственно, скорость этой реакции так мала, что она не способна конкурировать с гибелью радикалов СБ- на поверхности при давлениях первого предела самовоспламенения, близких к 100 Па. Таким образом, радикалы СБ - не участвуют в развитии цепей, по крайней мере, при температурах ниже 500 К. Это подтверждается результатами эксперимента, показывающими, что СБ- оседает на стенках. Поэтому реакция (I) является лишь стадией продолжения цепей, в которой размножение носителей цепей не происходит, и атом О заменяет другую активную промежуточную частицу - радикал БО-. Между тем факт самовоспламенения сероуглерода при тех же невысоких температурах указывает на наличие быстрой линейной реакции разветвления. Линейной реакцией размножения активных частиц является стадия
Б + О2 = БО- + О, (III)
причем обе образующиеся частицы: БО- и О, в силу больших величин констант скорости реакций
БО- + О2 = БО2 + О
(IV)
способны развивать реакционные цепи и тем самым реализовать размножение активных частиц, т.е. разветвление цепей.
Однако очевидно, что это разветвление может быть линейным только в том случае, если скорость образования атома Б, осуществляющего размножение свободных валентностей, также линейно зависит от концентрации активных промежуточных продуктов. Линейной реакцией образования атома Б является процесс прямого его замещения из молекулы СБ2:
О + СБ2 = ОСБ + Б. (V)
Реакция же диспропорционирования с образованием атома серы
БО- + БО- = БО2 + Б (VI)
не может объяснить наблюдаемое самовоспламенение СБ2, поскольку ее скорость зависит от концентраций промежуточных частиц БО- нелинейно.
В работах [23, 24] на примерах реакций атомарного водорода и дейтерия были обнаружены гомогенные и гетерогенные реакции непосредственного замещения и вытеснения атомов из разного типа многоатомных валентно-насыщенных молекул. Было также показано, что такие реакции характеризуются малыми энергиями активации и большими предэкспоненциальными множителями констант скорости, лишь ненамного меньшими числа двойных столкновений. Выявлен значительный вклад гетерогенных реакций такого типа в процессы горения и плазмохимию [24].
Настоящее исследование посвящено рассмотрению роли реакции (V) в процессе воспламенения и горения сероуглерода, а также выяснению характеристик активированного комплекса этого элементарного акта. Используются экспериментальные величины второго предела самовоспламенения. Наряду с анализом экспериментальных данных о воспламенении сероуглерода проводился также квантово-химический расчет системы О с СБ2.
Для объяснения нетеплового распространения пламени в работе [3] реакция (V) наряду с рядом других была включена в гипотетическую реакционную схему горения СБ2. При этом было оговорено, что предлагаемая схема является лишь одной из возможных и приводится лишь для наглядности. При получении выражения скорости пламени реакция (V) была опущена. В тех работах, в которых эта реакция приведена в качестве одной из возможных стадий в реакционных схемах горения сероуглерода, ее роль в развитии реакционных цепей не анализировалась, а в механизмах, предлагаемых, например, в работах [11-13], она вообще отсутствует. Критические условия самовоспламенения СБ2 в этих работах не рассматриваются. Между тем факт самовоспламенения сероуглерода означает, что в горении этого соединения важную роль играет линейное разветвление це-
пей. Соответственно, реакционные схемы, не учитывающие реакцию (V), не позволяют объяснить наблюдаемое самовоспламенение CS2, поскольку, как было сказано выше, лишь в этом акте образуется атомарная сера, способная осуществить линейное разветвление. Конечно, не все атомы S вступают в реакцию (III). В условиях второго предела они реагируют также по пути тримолекуляр-ного обрыва цепей:
S + O2 + M = SO3 + M. (VII)
Аналогичной по своей роли в процессе является реакция
SO- + O2 + M = SO3 + M. (VIII)
Поэтому эффективная скорость разветвления цепей равна скорости реакции (V), умноженной на доли тех атомов серы и радикалов SO-, которые вступают в реакции развития цепей (III) и
(IV), а не (VII) и (VIII).
Из сказанного выше очевидно, что реакция
(V) может служить поставщиком атомов серы со скоростью, необходимой для самовоспламенения, только в том случае, если она не только эффективно конкурирует с гибелью атомов O, но и обеспечивает такую скорость реакции (III), при которой разветвление цепей превалирует над их обрывом. Как известно (см., например, [5]), второй предел самовоспламенения определяется равенством скоростей бимолекулярного разветвления цепей и тримолекулярного их обрыва. Таким образом, используя равенство скоростей реакций разветвления и обрыва цепей, а также экспериментальные величины предела самовоспламенения, можно определить нижнюю границу величины константы скорости реакции (V) прямого вытеснения атома серы из CS2. По величине этой константы скорости можно определить верхнюю границу энергии активации. Согласие полученных таким образом величин константы скорости и энергии активации с соответствующими литературными данными, полученными принципиально другими методами, должно служить показателем определяющей роли реакции (V) в разветвлении реакционных цепей горения сероуглерода.
Поскольку реакция, лимитирующая разветвление, протекает с участием атомарного кислорода, то конкурирующая реакция обрыва тоже должна протекать с участием этой частицы. Такой тримо-лекул
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.