ЖУРНАЛ НЕОРГАНИЧЕСКОМ ХИМИИ, 2007, том 52, № 7, с. 1214-1217
ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ НЕОРГАНИЧЕСКИХ СИСТЕМ
УДК 546.65:541
ТРОЙНАЯ ВОДНО-СОЛЕВАЯ СИСТЕМА 8Ш(СС13С00)з-ЕГ(СС1ЗС00)З-Н20 ПРИ 298 К
© 2007 г. Л. С. Григорьева*, В. А. Батырева**
*Московский государственный строительный университет **Томский государственный университет им. ВВ. Куйбышева Поступила в редакцию 27.06.2006 г.
Методом изотермической растворимости при 298 К изучена система трихлорацетат самария-три-хлорацетат эрбия-вода. Состав твердых фаз установлен методом остатков Скрейнемакерса. Определены показатели преломления, удельный объем и вязкость жидкой фазы, а также показатели преломления твердых остатков. Установлено, что в системе образуется непрерывный ряд твердых растворов. Для образующихся твердых растворов рассчитаны некоторые термодинамические характеристики.
Цель настоящей работы - исследование методом изотермической растворимости системы трихлорацетат самария-трихлорацетат эрбия-вода при 298 К.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез трихлорацетатов самария и эрбия проводили по методике [1]. Полученные соли представляют собой тригидраты. Содержание редкоземельных элементов в составе солей определяли комплексонометрическим титрованием с ксиле-ноловым оранжевым [2], хлора - элементоорга-ническим анализом путем сжигания в микробомбе с металлическим натрием с дальнейшим титрованием хлорид-ионов [3]. Количество молекул воды находили по разности, а также методом дифференциального термического анализа.
Равновесие в системе устанавливалось в течение 7 сут непрерывного перемешивания со стеклянным бойком. После этого равновесные фазы разделяли и анализировали.
Сумму редкоземельных элементов определяли комплексонометрическим титрованием [2], концентрацию эрбия - спектрофотометрически [4].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
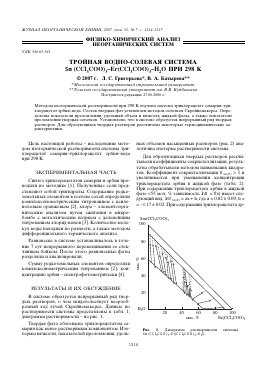
В системе образуется непрерывный ряд твердых растворов, о чем свидетельствует веерообразный ход лучей Скрейнемакерса. Данные по растворимости системы представлены в табл. 1, диаграмма растворимости - на рис. 1.
Твердая фаза обогащена трихлорацетатом самария как менее растворимым компонентом. Изотермы вязкости, показателей преломления, удель-
ных объемов насыщенных растворов (рис. 2) аналогичны изотерме растворимости системы.
Для образующихся твердых растворов рассчитывали коэффициенты сокристаллизации, результаты обрабатывали методом наименьших квадратов. Коэффициент сокристаллизации ^8т/ЕГ > 1 и увеличивается при уменьшении концентрации трихлорацетата эрбия в жидкой фазе (табл. 2). При содержании трихлорацетата эрбия в жидкой фазе <55 мол. % зависимость = /(.х) имеет следующий вид: 1и08т/Ег = ах + Ь, где а = 0.82 ± 0.09, Ь = = -1.17 ± 0.02. При содержании трихлорацетата эр-
Sm(Ca3COO)3
мае. % Ег(СС13СОО)3
Рис. 1. Диаграмма растворимости системы 8т(СС13С00)3-Ег(СС13С00)3-И20.
ТРОЙНАЯ ВОДНО-СОЛЕВАЯ СИСТЕМА 1215
Таблица 1. Растворимость в системе Sm(CQ3COO)3-Er(CQ3COO)3-H2O
Жидкая фаза Твердый остаток Кристаллизующаяся фаза
мас. %
8ш(са3соо)3 Ег(СС13СОО)3 8ш(СС13СОО)3 Ег(СС13СОО)3
60.40 0 92.20 0 8ш(СС13СОО)3 ■ 3Н2О
58.07 4.80 77.92 3.11 Твердый раствор
52.39 9.33 74.34 6.41 То же
48.49 15.17 74.41 10.67 »
46.09 17.47 61.75 14.86 »
41.02 21.76 67.02 17.49 »
38.55 25.37 64.64 22.09 »
34.17 29.45 56.91 25.53 »
30.50 33.43 55.13 30.12 »
29.49 36.28 50.14 33.24 »
20.40 46.09 36.49 44.85 »
17.66 48.63 28.13 45.58 »
14.08 51.27 24.33 49.29 »
14.73 51.98 24.16 50.02 »
13.71 53.13 22.02 54.07 »
13.49 52.99 20.80 55.00 »
10.08 55.87 18.50 66.35 »
7.31 60.05 12.64 76.51 »
0.96 66.94 1.54 88.51 »
0 68.60 0 92.36 Ег(СС13СОО)3 ■ 3Н2О
Таблица 2. Значения коэффициентов сокристаллизации, коэффициентов активности компонентов и изменение избыточной свободной энергии образования твердых растворов в системе Sm(CQ3COO)3-Er(CQ3COO)3-H2O
Состав тв. растворов, мол. д. Ег(СС13СОО)3 1п^Ег/Зш У 8ш(СС13СОО)3 У Ег(СС13СОО)3 АОе, Дж/моль
0.050 -1.13 1.00 2.28 105
0.100 -1.09 1.00 2.12 196
0.150 -1.05 1.01 1.97 273
0.200 -1.01 1.02 1.84 336
0.250 -0.969 1.03 1.72 385
0.300 -0.929 1.04 1.61 420
0.350 -0.987 1.02 1.79 539
0.400 -0.932 1.05 1.68 579
0.450 -0.876 1.07 1.58 604
0.500 -0.820 1.10 1.50 617
0.550 -0.765 1.13 1.42 616
0.600 -0.709 1.16 1.35 601
0.650 -0.654 1.21 1.29 573
0.700 -0.598 1.26 1.23 531
0.750 -0.543 1.31 1.18 477
0.800 -0.487 1.36 1.14 408
0.850 -0.432 1.43 1.10 326
0.900 -0.376 1.50 1.06 231
0.950 -0.321 1.58 1.03 122
1216
ГРИГОРЬЕВА, БАТЫРЕВА
П, сПз
20 10 0
V х 10-3, м3/кг 0.7 0.6
0.5
^
1.46 1.44
эффициенты активности рассчитывали по методу, предложенному в [5] по формуле:
-да-О-СГО—3
О—а—о_о п п 0,, о
и - -0 и " и КР
l££_o-^-o—с9
50 100
Sm(CaзCOO)з мол. % Ег(Са3ТОО)3
Рис. 2. Изотермы вязкости, удельных объемов и показателей преломления насыщенных растворов системы 8т(СС13С00)3-Ег(СС13С00)3-Н20.
бия >55 мол.% 1пЛ8т/Ег = а^х + Ь1, где а1 = 1.11 ± 0.11, Ь1 = -1.38 ± 0.08. Стандартное отклонение аппроксимации 1пП = /(х) s = 0.027.
Коэффициенты сокристаллизации использовали для расчета термодинамических функций компонентов бинарных твердых растворов. Ко-
п"
1п у! = | х2 1п Б").
э"( х2= 0)
Коэффициенты активности компонентов имеют значения, близкие к единице. Область твердых растворов на основе трихлорацетата самария при концентрации трихлорацетата эрбия до 45.0 мол. % можно отнести к "псевдоидеальной", коэффициенты активности основного компонента имеют постоянные значения, близкие к единице, коэффициенты активности второго компонента больше единицы (табл. 2).
Анализ зависимостей изменения активности компонентов от состава твердой фазы показывает, что твердые растворы трихлорацетатов самария-эрбия близки к идеальным.
Изменения свободной энергии образования (Д^) и избыточной свободной энергии образования (ДОм) (рис. 3) также свидетельствуют о близости твердых растворов трихлорацетатов самария-эрбия к идеальным. Кривая избыточной энергии образования имеет несколько асимметричный вид и незначительно отклоняется в положительную сторону от идеальности. Асимметричный характер изменения свободной энергии образования твердых растворов согласуется с правилом полярности Гольдшмидта и Ферсмана
ДG, Дж/моль
1000
500
8ш(аа3аоо)3
-1000 -
ДGE гу^—О-о—о—Ск^ 1
0.5
- \ мол. д.
о—о "о
ДGM
1 Ег(СС13СОО)3
Рис. 3. Изменение свободной энергии и избыточной свободной энергии образования твердых растворов в системе 8т(СС13С00)3-Ег(СС13С00)3-Н20.
ТРОЙНАЯ ВОДНО-
[6, 7]: при одинаковом координационном числе ионов катионы меньшего радиуса легче входят в решетку соединений с катионами большего радиуса, чем наоборот.
СПИСОК ЛИТЕРАТУРЫ
1. Tilley G.P., Roberts I.E. // Inorg. Chem. 1963. V. 2. № 4. P. 745.
2. Шварценбах Г., Флашка Г. // Комплексонометри-ческое титрование. М.: Химия, 1970. C.193.
ЛЕВАЯ СИСТЕМА 1217
3. Климова В.А. // Основные микрометоды анализа органических соединениий. М.: Химия, 1975. C. 21.
4. Полуэктов Н.С, Кононенко Л.И. Спектрофото-метрические методы определения индивидуальных редкоземельных элементов. Киев: Наук. думка, 1968. 170 с.
5. SchmelingP. // Svensk. kem. Tidskr. 1953. Т. 65. P. 123.
6. Goldschmidt VM. // J. Chem. Soc. 1937. V. 59. P. 655.
6. Ферсман А.Е. Избранные труды. М.: Изд-во АН СССР, 1952. Т. 1. С. 833.
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.